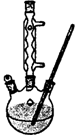- 物质的分离、提纯和除杂
- 共26题
除去下列括号内杂质的试剂或方法错误的是
正确答案
解析
略
知识点
氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌(含有Fe(Ⅱ), Mn(Ⅱ), Ni(Ⅱ)等杂质)的流程如下:
提示:在本实验条件下,Ni(Ⅱ)不能被氧化:高锰酸钾的还原产物是MnO2
回答下列问题:
(1)反应②中除掉的杂质离子是 ,发生反应的离子方程式为
加高锰酸钾溶液前,若pH较低,对除杂的影响是
(2)反应③的反应类型为 .过滤得到的滤渣中,除了过量的锌外还有
(3)反应④形成的沉淀要用水洗,检验沉淀是否洗涤干净的方法是
(4)反应④中产物的成分可能是ZnCO3·xZn(OH)2 。取干燥后的滤饼11.2g,煅烧后可得到产品8.1 g. 则x等于
正确答案
答案:
(1)Fe2+和Mn2+;
MnO4-+3Fe2++7H2O===MnO2↓+3Fe(OH)3↓+5H+;
3Mn2++2MnO4-+2H2O===5MnO2↓+4H+;
不会形成Fe(OH)3和MnO2沉淀。或无法除去Fe2+和Mn2+;
(2)置换反应;Ni
(3)取最后一次洗涤液少量,滴入稀盐酸,加入氯化钡溶液,没有白色沉淀生成,证明洗涤干净。
(4)1
解析
以工艺流程为形式考察化学知识,涉及反应原理、除杂方法、影响因素、反应类型、产物分析、洗涤干净的检验方法、化学计算等。
(1)除去的杂质离子是Fe2+和Mn2+;Fe2+以Fe(OH)3的形式沉淀下来,Mn2+以MnO2的形式沉淀下来;反应离子方程式为:
MnO4-+3Fe2++7H2O===MnO2↓+3Fe(OH)3↓+5H+;
3Mn2++2MnO4-+2H2O===5MnO2↓+4H+;
在加高锰酸钾溶液前,若pH较低,不会形成Fe(OH)3和MnO2沉淀。
(2)Zn+Ni2+===Zn2++Ni是置换反应;还有Ni。
(3)洗涤主要是除去SO42-和CO32-离子。检验洗净应该检验SO42-离子。取最后一次洗涤液少量,滴入稀盐酸,加入氯化钡溶液,没有白色沉淀生成,证明洗涤干净。
(4)令ZnCO3为amol,Zn(OH)2为bmol
125a+99b=11.2; 81(a+b)=8.1 解之,a:b=1:x=1:1,x=1
知识点
二氧化铈

(1)洗涤滤渣A的目的是为了去除 (填离子符号),检验该离子是否洗涤的方法是 。
(2)第②步反应的离子方程式是 ,滤渣B的主要成分是 。
(3)萃取是分离稀土元素的常用方法,已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP (填“能”或“不能”)与水互溶。实验室进行萃取操作是用到的主要玻璃仪器有 、烧杯、玻璃棒、量筒等。
(4)取上述流程中得到的



正确答案
(1)滤渣上附着的Fe3+、Cl-,取最后洗涤液少量,滴加AgNO3,如无白色沉淀,则洗干净。
(2)2CeO2+H2O2+6H+=2Ce3++O2 
(3)不能 分液漏斗
(4)97.01%
解析
该反应过程为:①CeO2、SiO2、Fe2O3等中加入稀盐酸,、Fe2O3转化FeCl3为存在于滤液中,滤渣为CeO2和SiO2②加入稀硫酸和H2O2,CeO2转化为Ce3+滤渣为SiO2③加入碱后Ce3+转化为沉淀,④通入氧气讲Ce从+3氧化为+4,得到产品。
Ce(OH)4~ FeSO4
n(Ce(OH)4)=n(FeSO4)=0.1000mol/L*1.025L=0.0025mol,m=0.0025mol*208g/mol=0.52g
知识点
下列除杂分离方法正确的是
正确答案
解析
略
知识点
自来水生产的流程示意图如下,下列说法错误的是
正确答案
解析
略
知识点
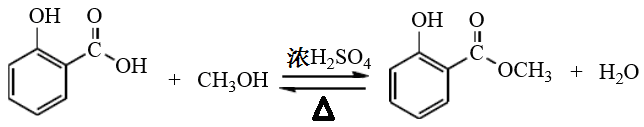
冬青油是天然香料之一,其主要成分为水杨酸甲酯,可由水杨酸(邻羟基苯甲酸)和甲醇作原料在浓硫酸催化下酯化而得。
实验步骤:
Ⅰ,如图,在100 mL三口烧瓶中放入6.9 g (0.05 mol)水杨酸和24 g(30 mL,0.75 mol)甲醇,向混合物中加入约10 mL甲苯,再小心地加入8 mL浓硫酸,摇动混匀:加入1~2粒沸石,装上回流冷凝管在石棉网上保持85—95℃,加热回流1.5-2小时
Ⅱ,待装置冷却后,分离出甲醇,向烧瓶中加入50 mL,水,然后转移至分液漏斗,分出下层产物,弃去上层水层,有机层再倒入分液漏斗中;依次用50 mL5%NaHCO3溶液洗1次(溶液呈弱碱性),30 mL水洗一次(产物皆在下层),有机层得到粗酯;
Ⅲ,将粗酯进行蒸馏,收集221℃~224℃的馏分。产品经0.5 g无水CaCl2干燥后称重。
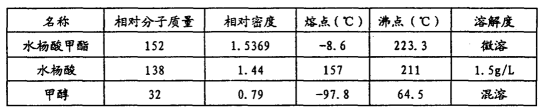
常用物理常数:
请根据以上信息回答下列问题:
(1)制备冬青油的化学方程式为______________。
(2)制备冬青油时,最合适的加热方法是_______________。实验中加入甲苯作带水剂的目的是____________________。
(3)反应结束冷却后,分离甲醇的操作是:___________________;
(4)在提纯粗产品的过程中,用碳酸氢钠溶液洗涤主要除去的杂质是____________:若
改用氢氧化钠溶液是否可以____________(填“可以”或“不可以”),其原因是________________。
(5)检验产品中是否含有水杨酸的化学方法是__________________。最终称得产品的质量为4.2 g,则所得水杨酸甲酯的产率为___________(保留两位有效数字)。
正确答案
答案:(1)
(2)水浴加热(1分) 反应产生的水从反应体系中分离开来,使得平衡向右 移动,同时可以减少甲醇的用量,从而提高反应的产率 (2分)
(3)蒸馏(1分)
(4)水杨酸(1分) 不可以(1分)
在氢氧化钠溶液中水杨酸甲酯发生水解(1分)
(5)取少量晶体于试管中,加蒸馏水溶解,滴加NaHCO3溶液,若出现无色气泡则 含水杨酸(答案合理即可)(2分) 55%(2分)
解析
略
知识点
下列关于实验原理或操作的叙述中,不正确的是:
正确答案
解析
本题是一组实验操作或原理的正误判断问题。实验操作的正误,实际根源还是实验原理。A、乙醇和碘与水均互溶,不能作为萃取剂使用。考查萃取原理。B、新制Cu(OH)2悬浊液用来检验醛基而不是羟基。C、纸层析实验中,不能将滤纸上的试样点浸入展开剂中,否则式样会溶解在展开剂中。D、除乙酸用碱性氧化物,氧化钙还能吸水,过滤后利用乙醇沸点低的原理进行蒸馏最好。
知识点
3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:
甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见下表:
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取。①分离出甲醇的操作是的 。
②萃取用到的分液漏斗使用前需 并洗净,分液时有机层在分液漏斗的 填(“上”或“下”)层。
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3 溶液洗涤的目的是 ;用饱和食盐水洗涤的目的是 。
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是 (填字母)。
a,蒸馏除去乙醚 b,,重结晶 c,过滤除去干燥剂 d,加入无水CaCl2干燥
(4)固液分离常采用减压过滤。为了防止倒吸,减压过滤完成后应先 ,再 。
正确答案
见解析。
解析
(1)①蒸馏② 检查是否漏水 上
(2)除去HCl 除去少量NaHCO3 且减少产物损失
(3)dcab
(4)拆去连接抽气泵和吸滤瓶的橡皮管 关闭抽气泵
知识点
下列实验方案不能达到预期目的的是
正确答案
解析
略
知识点
溴化钙可用作阻燃剂、制冷剂,具有易溶于水,易吸潮等性质。实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下:
完成下列填空:
(1)上述使用的氢溴酸的质量分数为26%,若用47%的氢溴酸配置26%的氢溴酸的氢溴酸500ml,所需的玻璃仪器有玻璃棒、 。
(2)已知步骤Ⅲ的滤液中不含NH
(3)试剂b是 ,步骤Ⅳ的目的是 。
(4)步骤Ⅴ所含的操作依次是 、 。
(5)制得的溴化钙可以通过如下步骤测定其纯度:
①称取4.00g无水溴化钙样品;
②溶解;
③滴入足量Na2CO3溶液,充分反应后过滤;
④ ;
⑤称量。若得到1.88g碳酸钙,则溴化钙的质量分数为 (保留两位小数)。
若实验操作规范而测定结果偏低,其原因是 。
正确答案
(1)量筒、胶头滴管、烧杯、500ml容量瓶。
(2)石灰水,沉淀
(3)氢溴酸,除去过量的氢氧化钙。
(4)蒸发浓缩,冷却结晶。
(5)洗涤;23.50%。洗涤时,有少量的碳酸钙溶解。
解析
(1)用浓溶液配制500ml稀溶液,计算需要的浓溶液的体积,然后溶解、配制500ml溶液,则需要量筒、胶头滴管、500ml容量瓶。
(2)加入的试剂需控制溶液的pH约为8.0,应为碱性,目的是除去杂质

(4)步骤V的结果得到
(5)④对滤渣洗涤,除去表面吸附的离子,根据


知识点
扫码查看完整答案与解析