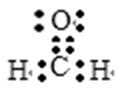- 位置结构性质的相互关系应用
- 共8题
helicopter
正确答案
interval
正确答案
X、Y、Z、W、R属于短周期元素。已知它们都不是稀有气体元素,X的原子半径最大,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数m-n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2︰1。 下列叙述错误的是( )
正确答案
解析
由题意“X的原子半径在短周期元素的原子中最大”可知X为钠元素;由“Z元素的原子L层电子数为m+n,Y元素的原子次外层电子数为n”则可知n=2,m=6,故可知Y为氧元素,Z为硅元素;由“W元素与Z元素同主族”可知W为碳元素;由“R元素原子与Y元素原子的核外电子数之比为2︰1”可知R为16号元素硫。A项中氧化钠和过氧化钠中阴、阳离子的个数比均为1∶2,正确;B项中忽视了水中存在氢键,错误;C项中酸性强弱顺序为硫酸>碳酸>醋酸,正确;D项中氧元素分别与硅、碳、硫元素组成的常见化合物有一氧化碳、二氧化碳、二氧化硅、二氧化硫和三氧化硫五种,正确。
知识点
短周期元素R、T、Q、W在元素周期表中的相对位置如右下图所示,其中T所处的周期序数与族序数相等。
正确答案
解析
通过题干信息: T所属的周期序数与族序数相等,可以判断出T是Al,从而推出Q是Si.W是S,R是N。最简单的气态氢化物的热稳定性:NH3>SiH4,A正确;最高价氧化物对应水化物的酸性:H2SiO3<H2SO4,B正确;原子半径:Al>Si>N,C正确;含Al的盐溶液中,虽然由于铝离子会水解呈酸性,但若酸根离子的水解程度更大,根据谁强显谁性的规律,该盐溶液也可能显碱性,D错误。。
知识点
下列判断正确的是
正确答案
解析
略
知识点
下表中实线表示目前元素周期表七个周期的部分边界。
请按要求回答下列问题:
7.请在上表中用实线画出从第三周期到第六周期金属和非金属的交界线。
8.元素
9.由元素
10.设计实验证明单质的还原性:
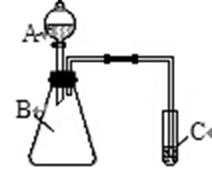
若利用右图装置实验,证明元素的非金属性:
__________________________________________________;但需在C的试管口处堵一块蘸有_____________溶液的棉花吸收尾气。
11.元素
欲将标准状况下8.96 L M(由元素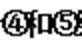
正确答案
考查方向
本小题考查了元素周期表的结构
解题思路
属于识记内容,记住铝和硅的位置。
教师点评
本题考查元素周期表结构,难度小,高考中出现概率低。
正确答案
H2O>H2S>PH3
考查方向
本题考查了氢化物的稳定性,元素周期律等知识。
解题思路
找出
教师点评
本题考查了氢化物的稳定性,元素周期律等知识。元素周期律在高考属于必考点,考查的形式多样,出现频率高。
正确答案
考查方向
本题考查了电子式等知识点。
解题思路
根据八电子稳定结构尝试写出最简单的结构。
教师点评
本题考查电子式的知识点,在全国卷出现概率低。
正确答案
2Na+2H2O=2NaOH+H2↑
S2-+Cl2=2Cl-+S↓
氢氧化钠溶液
考查方向
本题考查了实验探究元素周期律、氯气的实验室制备等知识点。
解题思路
可以利用还原性强的置换出还原性弱的,及金属活动性顺序。2Na+2H2O=2NaOH+H2↑
根据实验仪器和试剂可知是AB装置是制备氯气的装置,因此本题的思路是利用单质氧化性强弱判断非金属强弱,C中含有S2-被Cl2置换即可。最后一空为氯气的尾气吸收装置。
教师点评
本题通过实验探究元素周期律间接考查了化学方程式和离子方程式的书写,和元素化合物的性质及气体的制备等知识,内容比较基础,高考中出现概率中等。
正确答案
HNO3 = H++NO3-
硝酸铵属于强电解质,在水中完全电离,其中NH4+水解而使溶液显酸性
解析
第三问:n(NO)=8.96L/22.4L.mol=0.4mol
4NO+3O2+2H2O=4HNO3
4 3
0.4 x=0.3mol N=1.806x1023
考查方向
本题考查了氮元素及其化合物的知识点及盐类的水解,强电解质的电离方程式等知识点
解题思路
略(简单,识记内容)
教师点评
本题考查了NO与氧气与水完全反应的问题,在高考中出现的频率低。
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示, 其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是
正确答案
解析
略
知识点
科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如下图所示)。已知该分子中N-N-N键角都是108.1°,下列有关N(NO2) 3的说法正确的是 ( )
正确答案
解析
略
知识点
扫码查看完整答案与解析