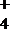- 重要的氧化剂
- 共22题
正确答案
知识点
1.化学与生活密切相关。下列应用中利用了物质氧化性的是
正确答案
知识点
6.下列各选项中所述的两个量,前者一定大于后者的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
9.用辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)制备难溶于水的碱式碳酸铜的流程如下:
(1)下列措施是为加快浸取速率,无法达到目的的是_________
A. 延长浸取时间
B. 将辉铜矿粉碎
C.充分搅拌
D.适当增加硫酸浓度
(2) 浸取反应中氧化剂的化学式为_________;滤渣Ⅰ的成分为MnO2、S和_________(写化学式);
(3)研究发现,若先除铁再浸取,浸取速率明显变慢,可能的原因是_________。
(4)“除铁”的方法是通过调节溶液PH,使Fe3+水解转化为Fe(OH)3,加入的试剂A可以是_____(化学式);“赶氨”时,最适宜的操作方法__________________。
(5)“沉锰”(除Mn2+)过程中反应的离子方程式__________________。
(6)滤液Ⅱ经蒸发结晶得到的盐主要是__________________(写化学式)。
正确答案
(1)A;
(2)MnO2 SiO2;
(3)Fe3+可催化Cu2S被MnO2氧化(或答:Fe2O3在浸取时起媒介作用)
(4)CuO[Cu(OH)2;将溶液加热
(5)Mn2+ +HCO3-+NH3 = MnCO3↓+ NH4+
(6)(NH4)2SO4
解析
解析已在路上飞奔,马上就到!
知识点
16.锌精矿经过焙烧后得到锌焙砂(主要含ZnO、ZnFe2O4、ZnSO4, 还有少量的FeO、CuO、NiO等氧化物),工业上可利用锌焙砂制取金属锌,其流程如下图所示。回答下列问题:
(1)酸浸时ZnFe2O4会生成两种盐,该反应的化学方程式为 。
(2)向酸浸后的溶液Ⅰ中加入H2O2的作用是什么?请用离子方程式表示:
。
(3)①加入X的作用是调节pH值,X可以是 。
A.NaOH B.ZnO
C.Zn D.ZnCO3
②25℃时,若要除尽Fe3+,需要调节pH= 。(离子浓度低于10﹣5mol•L﹣1时可认为已经除尽。已知25℃,Ksp[Fe( OH)3]=1.0×10﹣38)
(4)电解溶液Ⅳ还能得到一种气体,该气体是 。
(5)本流程中可以循环利用的物质除锌外还有 。
正确答案
(1)ZnFe2O4+4H2SO4═ZnSO4+Fe2(SO4)3+4H2O
(2)H2O2+2Fe2++2H+═2Fe3++2H2O
(3)BD; 3
(4)O2
(5)H2SO4
解析
解析已在路上飞奔,马上就到!
知识点
粗制的CuSO4·5H2O晶体中含有Fe2+。提纯时,为了除去Fe2+,常加入少量H2O2,
然后再加入少量碱至溶液pH=4,可以达到除去铁离子而不损失硫酸铜的目的。下列说法
不正确的是
正确答案
解析
略
知识点
吸进人体内的氧有2%转化为加速人体衰老的氧化性极强的活性氧,若Na2SeO3能清除人体内活性氧,则Na2SeO3的作用是()
正确答案
解析
略
知识点
9.下列各组物质间反应,其中水既不作氧化剂又不作还原剂的氧化还原反应是 ( )
①F2和H2O ②Na和H2O ③Na2O2和H2O
④NO2和H2O ⑤Na2O和H2O ⑥Cl2和H2O
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
25.纳米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂。
(1)工业上二氧化钛的制备是:
i.将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4。
ii.将SiCl4分离,得到纯净的TiCl4。
iii.在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O。
iiii.TiO2·xH2O高温分解得到TiO2。
①分离TiCl4与SiCl4所采取的操作名称是( )。
② Ⅲ中反应的化学方程式是( )。
③ 如Ⅳ在实验室完成,应将TiO2·xH2O放在( )(填仪器编号)中加热。
(2)据报道:“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2,其过程大致如下:
a.O2


① b反应过程破坏的化学键是( ) 。
② H2O2能清除路面空气中的CxHy、CO等,其主要是利用了H2O2的( )
(填“氧化性”或“还原性”)。
(3)某研究小组用下列装置模拟“生态马路”部分原理。(夹持装置已略去)
① 如缓慢通入22.4 L(已折算成标准状况)CO气体,结果NaOH溶液增重11 g,则CO的转化率为( )。
② 当CO气体全部通入后,还要再通一会儿空气,其目的是( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
24.以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
回答下列问题:
(1)将煅烧黄铁矿的化学方程式补充完整: FeS2+ O2 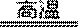
该反应中,FeS2为( )剂;SO2为( ),其常用于制备硫酸,反应过程中的化学反应方程式为( )、 SO3+H2O=H2SO4
(2)酸溶及后续过程中均需保持盐酸过量,其目的是提高铁元素的浸出率和 ( );
(3)通氯气氧化时,发生的主要反应的离子方程式为( );
(4)该过程产生的污染空气的气体有三种,尾气均可用强碱溶液吸收,其中氯气被吸收的离子方程式为( )。
(5)从FeCl3溶液中得到FeCl3.6H2O晶体的操作为 ( ) 。
正确答案
答案已在路上飞奔,马上就到!
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析