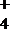- 重要的氧化剂
- 共22题
正确答案
知识点
1.化学与生活密切相关。下列应用中利用了物质氧化性的是
正确答案
知识点
6.下列各选项中所述的两个量,前者一定大于后者的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
9.用辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)制备难溶于水的碱式碳酸铜的流程如下:
(1)下列措施是为加快浸取速率,无法达到目的的是_________
A. 延长浸取时间
B. 将辉铜矿粉碎
C.充分搅拌
D.适当增加硫酸浓度
(2) 浸取反应中氧化剂的化学式为_________;滤渣Ⅰ的成分为MnO2、S和_________(写化学式);
(3)研究发现,若先除铁再浸取,浸取速率明显变慢,可能的原因是_________。
(4)“除铁”的方法是通过调节溶液PH,使Fe3+水解转化为Fe(OH)3,加入的试剂A可以是_____(化学式);“赶氨”时,最适宜的操作方法__________________。
(5)“沉锰”(除Mn2+)过程中反应的离子方程式__________________。
(6)滤液Ⅱ经蒸发结晶得到的盐主要是__________________(写化学式)。
正确答案
(1)A;
(2)MnO2 SiO2;
(3)Fe3+可催化Cu2S被MnO2氧化(或答:Fe2O3在浸取时起媒介作用)
(4)CuO[Cu(OH)2;将溶液加热
(5)Mn2+ +HCO3-+NH3 = MnCO3↓+ NH4+
(6)(NH4)2SO4
解析
解析已在路上飞奔,马上就到!
知识点
16.锌精矿经过焙烧后得到锌焙砂(主要含ZnO、ZnFe2O4、ZnSO4, 还有少量的FeO、CuO、NiO等氧化物),工业上可利用锌焙砂制取金属锌,其流程如下图所示。回答下列问题:
(1)酸浸时ZnFe2O4会生成两种盐,该反应的化学方程式为 。
(2)向酸浸后的溶液Ⅰ中加入H2O2的作用是什么?请用离子方程式表示:
。
(3)①加入X的作用是调节pH值,X可以是 。
A.NaOH B.ZnO
C.Zn D.ZnCO3
②25℃时,若要除尽Fe3+,需要调节pH= 。(离子浓度低于10﹣5mol•L﹣1时可认为已经除尽。已知25℃,Ksp[Fe( OH)3]=1.0×10﹣38)
(4)电解溶液Ⅳ还能得到一种气体,该气体是 。
(5)本流程中可以循环利用的物质除锌外还有 。
正确答案
(1)ZnFe2O4+4H2SO4═ZnSO4+Fe2(SO4)3+4H2O
(2)H2O2+2Fe2++2H+═2Fe3++2H2O
(3)BD; 3
(4)O2
(5)H2SO4
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析