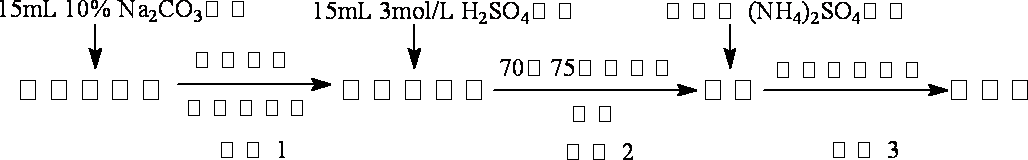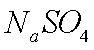- 制备实验方案的设计
- 共21题
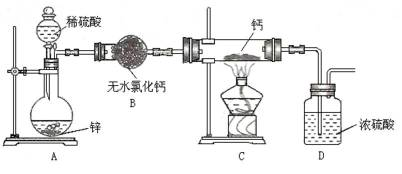
某研究小组利用题9图装置探究温度对CO还原Fe2O3的影响(固定装置略)
(1)MgCO3的分解产物为 。
(2)装置C的作用是 ,处理尾气的方法为 。
(3)将研究小组分为两组,按题9图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物)。两组分别用产物进行以下实验:
①乙组得到的黑色粉末是 。
②甲组步骤1中反应的离子方程式为 。
③乙组步骤4中,溶液变红的原因为 ,溶液褪色可能的原因及其验证方法为 。
④从实验安全考虑,题9图装置可采取的改进措施是 。
正确答案
见解析。
解析
(1)难溶的碳酸盐受热易分解为氧化物和CO2,因此MgCO3受热分解得到产物是MgO与CO2。
(2)结合实验目的可知在装置B处,CO2与Zn作用生成CO气体,进入后面装置进行实验,故装置C中NaOH是用来吸收CO中混有的CO2气体;CO气体不一定完全反应,因此尾气中会有CO,可利用其可燃性采取点燃法来进行尾气处理。
(3)①利用黑色固体可溶于盐酸并产生气体,结合“原子守恒”可知用酒精喷灯的乙组实验得到的固体为Fe;②利用甲组现象可知Fe2O3与CO在酒精灯加热的条件下,Fe2O3被还原得到黑色固体为Fe3O4,由此可写出反应的离子方程式;③因Fe3+遇SCN-显红色,所以步骤4中溶液变红是溶液中Fe2+被Cl2氧化为Fe3+所致、溶液褪色的原因可能是Cl2将SCN-氧化,若该假设成立,则溶液中还存在Fe3+,再继续加入KSCN溶液则溶液变红;④若B处停止加热后,C中液体易倒吸入B中引起玻璃管炸裂,因此可采取的改进措施是在装置B C之间添加装置E防倒吸。
知识点
氢化钙(CaH2)固体是登山运动员常用的能源提供剂。氢化钙要密封保存,一旦接触到水就发生反应生成氢氧化钙和氢气。氢化钙通常用氢气与金属钙加热制取,下图是模拟制取装置。
(1)与氢气相比,氢化钙作为能源提供剂的优点是 。
(2)装置B的作用是 ;装置D的作用是 ;反应开始前,先通入一段时间氢气的目的是 。
(3)为了确认进入装置C的氢气已经干燥,应在B、C之间再连接一装置,该装置中加入的试剂是 。
(4)利用上图装置进行实验,步骤如下:检查装置气密性后装入药品;打开分液漏斗活塞, (请按正确的操作顺序填入序号)。
①加热反应一段时间
②收集气体并检验其纯度
③关闭分液漏斗活塞
④停止加热,充分冷却
(5)上述实验中假设钙充分反应,为测定所得氢化钙的纯度,可称取44 mg 氢化钙样品与足量水反应,反应完全后充分冷却,最终生成气体体积约44.8mL(标准状况),试通过计算求样品中氢化钙的纯度 。若钙没有充分反应,对氢化钙纯度的测定 (填“有”或“无”)影响。
正确答案
见解析。
解析
(1)氢化钙是固体,携带方便
(2)除去氢气中的水蒸气
防止空气中进入C装置
排除装置中的空气
(3)无水硫酸铜
(4)②①④③
(5)95.5% 有
知识点
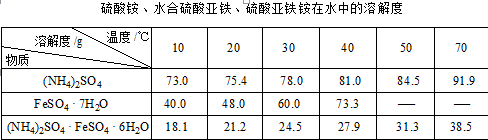
硫酸亚铁铵又称莫尔盐,是浅绿色晶体。它在空气中比一般亚铁盐稳定,是常用的Fe2+试剂。某实验小组利用工业废铁屑制取莫尔盐,并测定其纯度。
已知:①
②莫尔盐在乙醇溶剂中难溶。
Ⅰ.莫尔盐的制取
试分析:
(1)步骤2中加热方式 (填“直接加热”﹑“水浴加热”或“沙浴”);必须在铁屑少量剩余时,进行热过滤,其原因是 。
(2)步骤3中包含的实验操作名称 。
(3)产品莫尔盐最后用 洗涤(填字母编号)。
a.蒸馏水 b.乙醇 c.滤液
Ⅱ.为测定硫酸亚铁铵(NH4)2SO4•FeSO4•6H2O晶体纯度,某学生取m g硫酸亚铁铵样品配制成500 mL溶液,根据物质组成,甲、乙、丙三位同学设计了如下三个实验方案,请回答:
(甲)方案一:取20.00 mL硫酸亚铁铵溶液用0.1000 mol·L-1的酸性KMnO4溶液分三次进行滴定。
(乙)方案二:取20.00 mL硫酸亚铁铵溶液进行如下实验。
(1)若实验操作都正确,但方案一的测定结果总是小于方案二,其可能原因为
,验证推测的方法为: 。
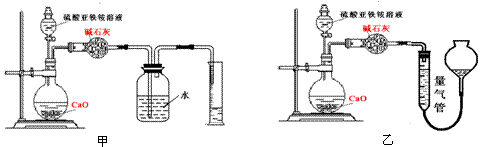
(丙)方案三:(通过NH4+测定)实验设计图如下所示。取20.00 mL硫酸亚铁铵溶液进行该实验。
(2)①装置 (填“甲”或“乙”)较为合理,判断理由是 。量气管中最佳试剂是 (填字母编号。如选“乙”则填此空,如选“甲”此空可不填)。
a.水 b.饱和NaHCO3溶液 c.CCl4
②若测得NH3的体积为V L(已折算为标准状况下),则该硫酸亚铁铵晶体的纯度为 。
正确答案
I.(1)水浴加热;防止Fe2+被氧化,同时热过滤可防止硫酸亚铁以晶体形式析出
(2)加热蒸发,浓缩结晶
(3) b
II.(1) Fe2+已被空气部分氧化 ;
取少量硫酸亚铁铵溶液,加入少量KSCN溶液,若溶液变为血红色,说明Fe2+已
被空气部分氧化
(2)①乙; 甲装置会出现倒吸); c
② 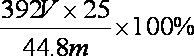
解析
略
知识点
利用渣磷灰石制取硫酸并联产水泥和磷酸二氢钠。已知磷灰石的主要成分是Ca3(PO4)2,具体生产流程如下:
(1)操作a需要的玻璃仪器有________,操作b的步骤为________。
(2)磷灰石粉碎的目的是________,磷酸的制备利用了浓硫酸的________性。
(3)已知2SO2(g)+O2(g)=2SO3(g)ΔH=-196.6KJ•mol-1,钒触媒(V2O5)是催化剂,在催化氧化的过程中产生了一连串的中间体(如图)。其中a、c二步的化学方程式可表示为:________、________。向容积为10L的密闭容器中充入2.0 mol SO2和1.0 mol O2,达到平衡后放出的热量为157.28KJ,该反应的平衡常数为________。
(4)磷酸(H3PO4)在水溶液中各种存在形式物质的量分数随pH的变化曲线如下图:
工业生产中为获取尽可能纯净的NaH2PO4,采取的措施为________。向体系中滴入稀盐酸后 ,pH从10降低到5的过程中发生的主要反应的离子方程为________。从图中推断当PH=14时,溶液中离子浓度的大小关系为________。
正确答案
(1)漏斗、烧杯、玻璃棒;蒸发浓缩、冷却结晶、过滤
(2)增大接触面积,加快反应速率;强酸
(3)SO2+V2O5=SO3+2VO2;2VOSO4+O2=V2O5+2SO3;800
(4)控制溶液的PH在4-5之间;HPO4-+H+=H2PO42-;[Na+]>[PO43-]>[OH-]>[HPO42-]>[H2PO4-]>[H+]
解析
略。
知识点
碳酸锂广泛应用于陶瓷和医药等领域。以


已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的PH分别为3.2、5.2、9.7和12.4;Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g。
(1)步骤Ⅰ前,
(2)步骤Ⅰ中,酸浸后得到的酸性溶液中含有Li+、SO42-,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,需在搅拌下加入_____________(填“石灰石”、“氯化钙”或“稀硫酸”)以调节溶液的PH到6.0~6.5,沉淀部分杂质离子,然后分离得到浸出液。
(3)步骤Ⅱ中,将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,可除去的杂质金属离子有______________。
(4)步骤Ⅲ中,生成沉淀的离子方程式为________________。
(5)从母液中可回收的主要物质是_____________。
正确答案
(1)增大固液接触面积,加快浸出反应速率,提高浸出率
(2)石灰石
(3)Fe2+、Mg2+、Ca2+
(4)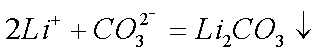
(5)
解析
略
知识点
扫码查看完整答案与解析