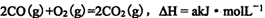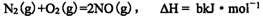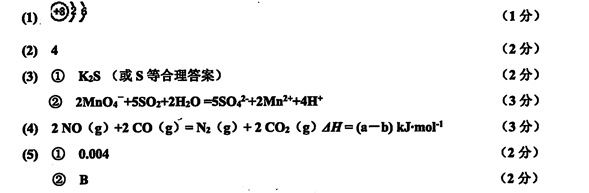- 原子结构示意图
- 共26题
10.根据原子结构及元素周期律的知识,下列推断正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
23. I.黑火药爆炸时发生多种化学反应,其中主要化学反应方程式为:
(1)上述反应中,原子半径最小的元素其原子结构示意图为____;
(2)上述反应中,每生成Imol氧化产物转移电子的物质的量为( )mol;
(3)收集黑吠药爆炸后的烟尘和气体产物,分别与酸性高锰酸钾溶液反应,均能使溶液紫红色退去。
①烟尘中能使酸性高锰酸钾溶液退色的物质的化学式是( )。
②气体产物与酸性高锰酸钾溶液反应的离子方程式( ),
II.汽车尾气中含有NO和CO等有害气体。选择适当的催化剂可将CO、NO转化为无毒气体。
(4)已知:
写出NO转化为无毒气体的热化学反应方程式____;
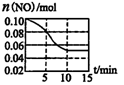
反应过程中NO气体的物质的量与时间的关系如图所示。
①0~5minNO的平均反应速率
②平衡时测得绝热容器内的压强比反应前增大,关于该反应
的说法正确的是____(填选项)
A.是气体分子数增多的反应
B.升高温度平衡常数减小
C.反应物的总能量小于生成物的总能量
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
请考生从给出的3道物理题、3道化学题、2道生物题中每科任选一题做答。
36.以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:
(1)写出反应Ⅰ的化学方程式 ( ) 。
(2)生产中,向反应II中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是( )。
(3)下列有关说法正确的是( ) 。
a.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
b.反应III中氧化剂与还原剂的物质的量之比为4︰1
c.反应IV需控制在60~
d.反应V中的副产物氯化铵可用作氮肥
(4)反应Ⅴ在25℃、40%乙二醇溶液中进行,不断有硫酸钾晶体从溶液中析出,硫酸钾的产率会超过90%,选用40%乙二醇溶液的原因是( )。
(5)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,写出二氧化氮与亚硫酸铵反应的化学方程式( ) 。37.[Cu(NH3)4]SO4·H2O是一种杀虫剂。
(1)Cu元素基态原子的电子排布式为___ ____。
(2)元素N、O、S的第一电离能由大到小排列的顺序为___ __。
(3)H元素可与O元素形成H2O和H2O2,H2O2易溶于H2O,其主要原因为___ ___。
(4)H元素与N元素可组成化合物N2H4,其中N原子的轨道杂化方式为___ ___。
(5)与SO互为等电子体的一种分子的化学式为 ___ ___。
(6)Cu元素与H元素可形成一种红色晶体,其结构如图8,则该化合物的化学式为__ __。38.菠萝酯是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸
(1)甲一定含有的官能团的名称是( ) 。
(2)5.8g甲完全燃烧可产生0.3mol CO2和0.3 mol H2O,甲蒸气对氢气的相对密度是29,甲分子中不含甲基,且为链状结构,其结构简式是( )。
(3)苯氧乙酸有多种酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且有2种一硝基取代物的同分异构体是(写
(4)已知:R-C

R-ONa
菠萝酯的合成路线如下:
①试剂X不可选用的是(选填字母)( ) 。
a. CH3COONa溶液
b. NaOH溶液
c. NaHCO3溶液
d.Na
②丙的结构简式是 ( ),反应II的反应类型是 ( ) 。
③反应IV的化学方程式是( ) 。
37.[Cu(NH3)4]SO4·H2O是一种杀虫剂。
(1)Cu元素基态原子的电子排布式为___ ____。
(2)元素N、O、S的第一电离能由大到小排列的顺序为___ __。
(3)H元素可与O元素形成H2O和H2O2,H2O2易溶于H2O,其主要原因为______。
(4)H元素与N元素可组成化合物N2H4,其中N原子的轨道杂化方式为___ ___。
(5)与SO互为等电子体的一种分子的化学式为___ ___。
(6)Cu元素与H元素可形成一种红色晶体,其结构如图8,则该化合物的化学式为____。
38.菠萝酯是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸
(1)甲一定含有的官能团的名称是( )。
(2)5.8g甲完全燃烧可产生0.3mol CO2和0.3 mol H2O,甲蒸气对氢气的相对密度是29,甲分子中不含甲基,且为链状结构,其结构简式是 ( )。
(3)苯氧乙酸有多种酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且有2种一硝基取代物的同分异构体是(写出任意2种的结构简式)( ) 。
(4)已知:
菠萝酯的合成路线如下:
①试剂X不可选用的是(选填字母)( ) 。
a. CH3COONa溶液
b. NaOH溶液
c. NaHCO3溶液
d.Na
②丙的结构简式是( ),反应II的反应类型是( ) 。
③反应IV的化学方程式是( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
请考生从给出的3道物理题、3道化学题、2道生物题中每科任选一题做答。
36. (1)钢铁工业对促进经济和社会发展起了重要作用。
①不锈钢含有的Cr元素是在炼钢过程的氧吹( )(填“前”或“后”)加入。
②炼钢时,加入硅、锰和铝的目的是( ) 。
③炼铁和炼钢生产中,尾气均含有的主要污染物是( ) 。从环保和经济角度考虑,上述尾气经处理可用作 ( ) 。
(2)纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。
①“氨碱法”产生大量CaCl2废弃物,写出该工艺中产生CaCl2的化学方程式:( );
②写出“联合制碱法”有关反应的化学方程式:( ) ;
③CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?( ) 。
37. 碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛。
(1)C60分子中每个原子接2个单键和一个双键,它与F2发生加成反应,其加成产物为 ( );C60的晶体中,每个C60晶胞的质量为( )。(用含NA的式子表示)
(2)干冰和冰是两种常见的分子晶体,下列关于两种晶体的比较中正确的是( ) 。
a.晶体的密度:干冰>冰 b.晶体的熔点:干冰>冰
c.晶体中的空间利用率:干冰>冰 d.晶体中分子间相互作用力类型相同
(3)金刚石和石墨是碳元素形成的两种常见单质,下列关于这两种单质的叙述中正确的有:( )
a.金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2杂化;
b.晶体中共价键的键长:金刚石中C—C<石墨中C—C;
c.晶体的熔点:金刚石>石墨
d.晶体中共价键的键角:金刚石>石墨
e.金刚石晶体中只存在共价键,石墨晶体中则存在共价键、金属键和范德华力;

(4)金刚石晶胞结构如图,立方BN结构与金刚石相似,在BN晶体中,B原子周围最近的N原子所构成的立体图形为( )B原子与N原子之间共价键与配位键的数目比为( ),一个晶胞中N原子数目为( ) 。
(5)C与孔雀石共热可以得到金属铜,铜原子的原子结构示意图为( ),金属铜采用面心立方最密堆积,则Cu的晶体中Cu原子的配位数为( )。已知Cu单质的晶体密度为
38. 有机物A的分子式为C9 H10 O2,A在光照条件下生成的一溴代物B,可发生如下转化关系(无机产物略):
其中K物质与氯化铁溶液发生显色反应,且环上的一元取代物只有两种结构。
已知:①当羟基与双键碳原子相连时,易发生如下转化:RCH=CHOH→RCH2CHO;
② —ONa连在烃基上不会被氧化。
请回答下列问题:
(1)F与I中具有相同的官能团,检验该官能团的试剂是( )。
(2)上述变化中属于水解反应的是( )(填反应编号)。
(3)写出结构简式,G:( ),M:( ) 。
(4)写出下列反应的化学方程式:反应①:( ),K与少量的氢氧化钠溶液反应: ( )。
(5)同时符合下列要求的A的同分异构体有( )种。
I.含有苯环 Ⅱ.能发生银镜反应和水解反应
Ⅲ.在稀氢氧化钠溶液中,1mol该同分异构体能与1mol NaOH反应
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
23.下表所列是元素周期表部分短周期的主族元素
已知R为地壳中含量最多的金属元素。
(1)写出Z的原子结构示意图________。
(2)W与氢原子形成6原子分子的结构简式_______。
(3)超细RX粉末被应用于大规模集成电路领域。其制作原理为R2Y3.X2.W在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:1;其反应的化学方程式为_______。
(4)X最高价氧化物对应水化物与X气态氢化物反应的生成物溶于水中,所得溶液离子浓度从大到小的顺序是_______。
(5)火箭发动机的燃料胼(N2H4)与氧化剂N204反应生成N2和水蒸气。

写出肼和N2O4反应的热化学方程式______________。
(6)温度为T时,向2.0 L恒容密闭容器中充入1.00 mol PCl5,反应

相同温度下,起始时向容器中充入1.00 mol PC15.0.20 mol PCl3和0.40 mol Cl2,反应达到平衡前v(正) _______v(逆)(填“>”或“=”或“<”);原因是_______。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析