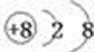- 有机化合物命名
- 共20题
5.烷烃
正确答案
解析
选择分子中含有碳原子数最多的碳链为主链,并从离支链较近的一端给主链的碳原子编号,该物质的名称是2-甲基-3-乙基己烷,故选项D正确。
考查方向
解题思路
烷烃的
易错点
不清楚烷烃的命名的规则。
知识点
11.高纯碳酸锰在电子工业中有重要的应用,湿法浸出软锰矿(主要成分为MnO2,含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的实验过程如下:
(1)浸出:浸出时温度控制在90℃~95℃之间,并且要连续搅拌3小时的目的是_______,植物粉的作用是_______。
(2)除杂:①向浸出液中加入一定量的碳酸锰矿,调节浸出液的pH为3.5~5.5;
②再加入一定量的软锰矿和双氧水,过滤;
③…
操作①中使用碳酸锰调pH的优势是_______;操作②中加入双氧水不仅能将Fe2+氧化为Fe3+,而且能提高软锰矿的浸出率。写出双氧水提高软锰矿浸出率的离子方程式_____________________。
(3)制备:在30 ℃~35 ℃下, 将碳酸氢铵溶液滴加到硫酸锰净化液中, 控制反应液的最终pH在6.5~7.0,得到MnCO3沉淀。温度控制35 ℃以下的原因是______________;该反应的化学方程式为_____________________;生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是______________。
(4)计算:室温下,Ksp(MnCO3)=1.8×10-11,Ksp(MgCO3)=2.6×10-5 ,已知离子浓度小于1.0×10-5mol·L-1时,表示该离子沉淀完全。若净化液中的c(Mg2+)=10-2mol/L,试计算说明Mg2+的存在是否会影响MnCO3的纯度。
正确答案
(1)提高软锰矿中锰的浸出率 作还原剂
(2)增加MnCO3的产量(或不引入新的杂质等) MnO2 + H2O2 + 2H+ =Mn2+ + 2H2O +O2↑
(3)减少碳酸氢铵的分解,提高原料利用率;
MnSO4 + 2NH4HCO3 
取最后一次的洗涤滤液1~2 mL 于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净。
(4)Ksp (MnCO3)=c(Mn2+)·c(CO32-) ,当Mn2+沉淀完全时,c(CO32-)=1.8×10-11/1.0×10-5=1.8×10-6 mol·L-1,若Mg2+也能形成沉淀,则要求Mg2+>2.6×10-5/1.8×10-6=14.4 mol·L-1, Mg2+的浓度0.01mol/L远小于14.4 mol·L-1。
解析
湿法浸出软锰矿(主要成分为MnO2,含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰,加入浓硫酸和植物粉浸出过滤得到滤液除去杂质,加入碳酸氢铵形成沉淀通过一系列操作得到高纯碳酸锰;
(1)升温、搅拌都可以加快物质的溶解反应速率,浸出时温度控制在90℃~95℃之间,并且要连续搅拌3小时的目的是提高软锰矿中锰的浸出率;加入植物粉是一种还原剂,
故答案为:提高软锰矿中锰的浸出率,作还原剂;
(2)使用碳酸锰调pH的优势是不引入新的杂质;酸性溶液中二氧化锰氧化过氧化氢为氧气,本身被还原为锰离子,反应的离子方程式为:MnO2+H2O2+2H+=Mn2++2H2O+O2↑,
故答案为:增加MnCO3的产量(或不引入新的杂质等); MnO2+H2O2+2H+=Mn2++2H2O+O2↑;
(3)依据碳酸氢铵受热易分解分析,温度控制35℃以下的原因是防止碳酸氢铵分解,在30℃~35℃下,将碳酸氢铵溶液滴加到硫酸锰净化液中,控制反应液的最终pH在6.5~7.0,得到MnCO3沉淀,硫酸铵,二氧化碳和水,反应的化学方程式为:MnSO4+2NH4HCO3
故答案为:减少碳酸氢铵的分解,提高原料利用率;MnSO4+2NH4HCO3 
(4)Ksp (MnCO3)=c(Mn2+)•c(CO32-),当Mn2+沉淀完全时,
答:Ksp (MnCO3)=c(Mn2+)•c(CO32-),当Mn2+沉淀完全时,
考查方向
解题思路
湿法浸出软锰矿(主要成分为MnO2,含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰,加入浓硫酸和植物粉浸出过滤得到滤液除去杂质,加入碳酸氢铵形成沉淀通过一系列操作得到高纯碳酸锰;
(1)升温搅拌都可以加快物质的溶解反应速率;加入植物粉是一种还原剂;
(2)使用碳酸锰调pH的优势是不引入新的杂质;二氧化锰氧化过氧化氢为氧气,本身被还原为锰离子;
(3)依据碳酸氢铵受热易分解分析,在30℃~35℃下,将碳酸氢铵溶液滴加到硫酸锰净化液中,控制反应液的最终pH在6.5~7.0,得到MnCO3沉淀,硫酸铵,二氧化碳和水,生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是取最后一次洗涤液检验是否含有硫酸根离子设计;
(4)Ksp (MnCO3)=c(Mn2+)•c(CO32-),当Mn2+沉淀完全时,c(CO32-)=1.8×10-11/1.0×10-5=1.8×10-6 mol•L-1,若Mg2+也能形成沉淀,则要求Mg2+>2.6×10-5/1.8×10-6=14.4 mol•L-1,Mg2+的浓度0.01mol/L远小于14.4 mol•L-1.
易错点
把握流程分析及混合物分离方法、发生的反应为解答的关键
知识点
Ⅰ.2013年6月“蛟龙”号载人潜水器投入应用后,计划每年将有4至5个月的海上时间用于深海探矿。
II.无机盐X仅由三种短周期元素组成,其相对分子质量为238,原子个数比为1︰1︰4。将23.8gX与水共热,生成一种有特殊臭味的气体单质A和某强酸的酸式盐溶液B,B的焰色反应呈黄色,在溶液B中加入足量的BaCl2溶液,产生46.6g白色沉淀。请推测并回答:
14.“蛟龙”号外壳是用特殊的钛铝合金材料制成,它可以在深海中承受700个大气压的压力。
①铝元素在周期表中的位置是 ▲ 。
②工业上可以用电解法或金属热还原法制金属钛。电解熔融的TiCl4可以制得金属钛,则TiCl4为 ▲ 化合物(填“离子”或“共价”);在1070K 用熔融的镁在氩气中还原TiCl4可得多孔的海绵钛,该反应的化学方程式 ▲ 。
15.锰结核中的黄铜矿(主要成分为CuFeS2)是海洋矿物中的一种,它是制取铜及其化合物的主要原料之一。据报道,有一种名叫Thibacillus ferroxidans的细菌,在硫酸溶液中利用氧气可以将黄铜矿氧化成硫酸盐。若CuFeS2中Fe的化合价为+2,试配平该反应的化学方程式: CuFeS2+ H2SO4+ O2 = CuSO4+ Fe2(SO4)3+ H2O
16.单质A有很强的氧化性,可用于净化空气,饮用水消毒等。A中组成元素的简单离子结构示意图为 ▲ 。
17.X的化学式 ▲ 。
18.实验室可通过低温电解B溶液制备X。该电解反应的化学方程式 ▲ 。
19.X氧化能力强,对环境友好,可用于脱硝、脱硫。在碱性条件下,X氧化NO的离子方程式 ▲ 。
20.振荡,观察现象。若加入硫酸铜溶液的反应快,说明Cu2+起了催化作用,反之Cu2+不起作用。写出X与铜反应的化学方程式 ▲ ,判断该同学设计的验证方法合理性并说明理由 ▲ 。
正确答案
①第三周期ⅢA族;②离子;2Mg+TiCl4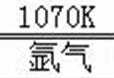
解析
①对应主族元素,周期数=电子层数、主族族序数=最外层电子数,Al原子原子核外电子层数为3、最外层电子数为3,则Al处于周期表中:第三周期ⅢA族,故答案为:第三周期ⅢA族;
②电解熔融的TiCl4可以制得金属钛,TiCl4在熔融状态下可以导电,属于离子化合物;在1070K 用熔融的镁在氩气中还原TiCl4可得多孔的海绵钛,即发生还原反应生成Ti与氯化镁,反应方程式为:2Mg+TiCl4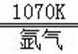

考查方向
解题思路
①Al原子原子核外电子层数为3、最外层电子数为3;
②电解熔融的TiCl4可以制得金属钛,TiCl4在熔融状态下可以导电,属于离子化合物;
在1070K 用熔融的镁在氩气中还原TiCl4可得多孔的海绵钛,即发生还原反应生成Ti与氯化镁;
易错点
第一题考查氧化还原反应配平、结构与位置关系、信息获取与迁移应用等,掌握氧化还原反应常用配平方法,第二题题考查无机物推断,属于计算型推断,题目素材在中学中比较陌生,侧重考查学生计算能力、分析推理能力、元素化合物知识以及对知识的迁移运用能力,难度中等。
正确答案
4;2;17;4;2;2。
解析
CuFeS2中Fe元素化合价由+2升高为+3价,S元素化合价由﹣2价升高为+6价,总共升高17价,氧气中氧气化合价由0价降低为﹣2价,总降低4价,化合价升降最小公倍数为68,故CuFeS2的系数为4、O2的系数为17,根据原子守恒配平后方程式为:4 CuFeS2+2 H2SO4+17 O2═4CuSO4+2 Fe2(SO4)3+2 H2O,
故答案为:4;2;17;4;2;2。
考查方向
解题思路
CuFeS2中Fe元素化合价由+2升高为+3价,S元素化合价由﹣2价升高为+6价,总共升高17价,氧气中氧气化合价由0价降低为﹣2价,总降低4价,化合价升降最小公倍数为68,故CuFeS2的系数为4、O2的系数为17,再根据原子守恒配平。
易错点
第一题考查氧化还原反应配平、结构与位置关系、信息获取与迁移应用等,掌握氧化还原反应常用配平方法,第二题题考查无机物推断,属于计算型推断,题目素材在中学中比较陌生,侧重考查学生计算能力、分析推理能力、元素化合物知识以及对知识的迁移运用能力,难度中等。
正确答案
解析
单质A为O3,组成元素的简单离子结构示意图为: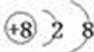
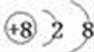
考查方向
解题思路
无机盐X仅由三种短周期元素组成,其相对分子质量为238,23.8gX的物质的量为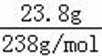
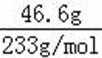
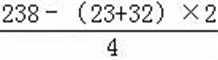
易错点
第一题考查氧化还原反应配平、结构与位置关系、信息获取与迁移应用等,掌握氧化还原反应常用配平方法,第二题题考查无机物推断,属于计算型推断,题目素材在中学中比较陌生,侧重考查学生计算能力、分析推理能力、元素化合物知识以及对知识的迁移运用能力,难度中等。
正确答案
Na2S2O8;
解析
X的化学式为:Na2S2O8,故答案为:Na2S2O8;
考查方向
解题思路
无机盐X仅由三种短周期元素组成,其相对分子质量为238,23.8gX的物质的量为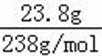

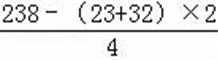
易错点
第一题考查氧化还原反应配平、结构与位置关系、信息获取与迁移应用等,掌握氧化还原反应常用配平方法,第二题题考查无机物推断,属于计算型推断,题目素材在中学中比较陌生,侧重考查学生计算能力、分析推理能力、元素化合物知识以及对知识的迁移运用能力,难度中等。
正确答案
2NaHSO4
解析
实验室可通过低温电解NaHSO4溶液制备Na2S2O8,该电解反应的化学方程式为:2NaHSO4

考查方向
解题思路
无机盐X仅由三种短周期元素组成,其相对分子质量为238,23.8gX的物质的量为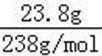
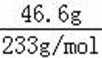
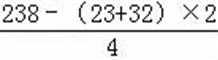
易错点
第一题考查氧化还原反应配平、结构与位置关系、信息获取与迁移应用等,掌握氧化还原反应常用配平方法,第二题题考查无机物推断,属于计算型推断,题目素材在中学中比较陌生,侧重考查学生计算能力、分析推理能力、元素化合物知识以及对知识的迁移运用能力,难度中等。
正确答案
3S2O82﹣+2NO+8OH﹣=6SO42﹣+2NO3﹣+4H2O
解析
X氧化能力强,对环境友好,可用于脱硝、脱硫.在碱性条件下,Na2S2O8氧化NO的离子方程式为:3S2O82﹣+2NO+8OH﹣=6SO42﹣+2NO3﹣+4H2O,故答案为:3S2O82﹣+2NO+8OH﹣=6SO42﹣+2NO3﹣+4H2O;
考查方向
解题思路
无机盐X仅由三种短周期元素组成,其相对分子质量为238,23.8gX的物质的量为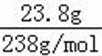

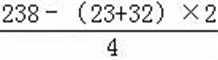
易错点
第一题考查氧化还原反应配平、结构与位置关系、信息获取与迁移应用等,掌握氧化还原反应常用配平方法,第二题题考查无机物推断,属于计算型推断,题目素材在中学中比较陌生,侧重考查学生计算能力、分析推理能力、元素化合物知识以及对知识的迁移运用能力,难度中等。
正确答案
Na2S2O8+Cu=Na2SO4+CuSO4 该同学的验证方法不合理,因为加入CuSO4溶液,反应速率快也可能是SO42﹣起催化作用
解析
Na2S2O8与铜反应的化学方程式:Na2S2O8+Cu=Na2SO4+CuSO4,该同学的验证方法不合理,因为加入CuSO4溶液,反应速率快也可能是SO42﹣起催化作用,
故答案为:Na2S2O8+Cu=Na2SO4+CuSO4;该同学的验证方法不合理,因为加入CuSO4溶液,反应速率快也可能是SO42﹣起催化作用。
考查方向
解题思路
无机盐X仅由三种短周期元素组成,其相对分子质量为238,23.8gX的物质的量为
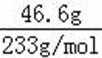
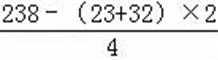
易错点
第一题考查氧化还原反应配平、结构与位置关系、信息获取与迁移应用等,掌握氧化还原反应常用配平方法,第二题题考查无机物推断,属于计算型推断,题目素材在中学中比较陌生,侧重考查学生计算能力、分析推理能力、元素化合物知识以及对知识的迁移运用能力,难度中等。
6.下列事实或实验可以表明H2SO3的酸性强于H2CO3的是
正确答案
解析
A.元素的非金属性越强,其最高价氧化物的水化物酸性越强,硫的非金属性比碳强,则硫酸的酸性大于碳酸,但不能证明亚硫酸酸性大于碳酸,故A错误;
B.SO2气体依次通过NaHCO3溶液、澄清石灰水,澄清石灰水变浑浊,二氧化硫、二氧化碳都能和澄清石灰水反应生成沉淀,该实验现象不能说明亚硫酸、碳酸酸性关系,故B错误;
C.两种气体的溶解度不同,导致其溶液浓度不同,则无法判断酸性强弱,故C错误;
D.室温下测定均为0.1mol/L的NaHSO3和NaHCO3溶液的pH,前者小于后者,说明亚硫酸根离子水解程度小于后者,则证明亚硫酸酸性大于碳酸,故D正确
考查方向
实验设计
解题思路
强酸能和弱酸盐反应生成弱酸,相同浓度的钠盐溶液,溶液的pH越大其相对应的酸越弱,据此分析解答
易错点
C项:由于SO2、CO2的溶解度不同,导致其溶液浓度不同
教师点评
本题考查酸性强弱判断,为高频考点,明确酸性强弱与其对应酸根离子水解程度关系、非金属氧化物的性质等知识点是解本题关键
知识点
5.下列有关实验操作、现象、解释和结论都正确的是
正确答案
知识点
扫码查看完整答案与解析