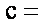- 相对分子质量的测定
- 共4题
【科目】化学
某化学研究小组探究无水三草酸合铁酸钾K3[Fe(C2O4)3]受热分解的产物,并对所得气体产物和固体产物进行验证,按下图装置进行实验(夹持仪器已略去)。
24.连接好装置后,加入药品前,应该进行的实验操作是________________(填操作名称)。
25.实验开始时缓缓通入氮气,过一段时间以后,加热反应管A和E ,待反应完全后,停止加热,仍继续通氮气,直到反应管冷却。停止加热前是否需要先断开A、B的连接处和E、F的连接处?为什么?
_______________________________________________________________。
26.实验中观察到B中澄清石灰水变浑浊,则说明气体产物中有
(写化学式)。能证明分解产物中有CO气体生成的实验现象是 。
27.该小组同学查阅资料后得知,固体产物中不存在+3价Fe元素,而盐类物质只有K2CO3。
① 验证固体产物中钾元素存在的方法是 ,
现象是 。
② 研究小组为探究铁元素的存在形式,取A中充分反应后所得固体于试管中,加入足量蒸馏水,过滤、洗涤、干燥得到黑色粉末,取4.4g黑色粉末溶于足量稀硝酸中,收集到标准状况下NO气体1.12L通过计算判断黑色粉末的成分为 (写化学式)。写出黑色粉末溶于足量稀硝酸发生反应的离子方程式: 。
正确答案
检查装置的气密性
考查方向
解题思路
探究无水三草酸合铁酸钾K3[Fe(C2O4)3]受热分解的产物:连接好装置后,加入药品前,应该进行的实验操作是检验装置气密性,利用氮气提供惰性环境,避免干扰分解产物的分析和验证,装置A:无水三草酸合铁酸钾K3[Fe(C2O4)3]受热分解,装置B:将气体产物通过澄淸石灰水,观察到澄清石灰水变浑浊,有CO2生成,装置C:用氢氧化钠将CO2除尽,装置D:净化(干燥)剩余产物气体,装置E:检验CO(用CuO,变红),装置F:检验有CO2生成(CO的氧化产物).分析装置图可知,利用氮气提供惰性环境,避免干扰分解产物的分析和验证,加入药品前,应该进行的实验操作是检验装置气密性;【解析】:装置图分析可知,利用生成氮气提供惰性环境,避免干扰分解产物的分析和验证,加入药品前,应该进行的实验操作是检查装置气密性检查,
故答案为:检查装置气密性检查;
易错点
元素及其化合物性质、离子方程式书写等知识
正确答案
不需要 因为N2不断通入,B、F瓶溶液不会倒吸。
解析
: 实验结束后,需要继续通入氮气直到玻璃管冷却,氮气气体进入B和F中溶液中,所以不会出现倒吸现象,故答案为:否;因为N2不断通入,B、F瓶溶液不会倒吸;
考查方向
解题思路
探究无水三草酸合铁酸钾K3[Fe(C2O4)3]受热分解的产物:连接好装置后,加入药品前,应该进行的实验操作是检验装置气密性,利用氮气提供惰性环境,避免干扰分解产物的分析和验证,装置A:无水三草酸合铁酸钾K3[Fe(C2O4)3]受热分解,装置B:将气体产物通过澄淸石灰水,观察到澄清石灰水变浑浊,有CO2生成,装置C:用氢氧化钠将CO2除尽,装置D:净化(干燥)剩余产物气体,装置E:检验CO(用CuO,变红),装置F:检验有CO2生成(CO的氧化产物).根据实验结束后,需要继续通入氮气直到玻璃管冷却来分析;
易错点
元素及其化合物性质、离子方程式书写等知识
正确答案
CO2 E中黑色固体变成红色,F中溶液变浑浊
解析
:B中是澄清石灰水,生成沉淀证明生成二氧化碳,证明一氧化碳生成可以利用装置E中黑色固体变成红色,F中溶液变浑浊,说明一氧化碳还原氧化铜反应生成二氧化碳通过F澄清石灰水变浑浊,故答案为:CO2;E中黑色固体变成红色,F中溶液变浑浊;
考查方向
解题思路
探究无水三草酸合铁酸钾K3[Fe(C2O4)3]受热分解的产物:连接好装置后,加入药品前,应该进行的实验操作是检验装置气密性,利用氮气提供惰性环境,避免干扰分解产物的分析和验证,装置A:无水三草酸合铁酸钾K3[Fe(C2O4)3]受热分解,装置B:将气体产物通过澄淸石灰水,观察到澄清石灰水变浑浊,有CO2生成,装置C:用氢氧化钠将CO2除尽,装置D:净化(干燥)剩余产物气体,装置E:检验CO(用CuO,变红),装置F:检验有CO2生成(CO的氧化产物).B中是澄清石灰水,生成沉淀证明生成二氧化碳,证明一氧化碳生成可以利用装置E中黑色固体变成红色,F中溶液变浑浊,说明一氧化碳还原氧化铜反应生成二氧化碳通过F澄清石灰水变浑浊;
易错点
元素及其化合物性质、离子方程式书写等知识
正确答案
焰色反应 透过蓝色的钴玻璃观察到紫色火焰 ;FeO 和Fe 3FeO +10H+ +NO3-=3Fe3++NO↑+5H2O;Fe+4H+ +NO3-=Fe3++NO↑+2H2O
解析
:①验证固体产物中钾元素存在的实验方法用焰色反应,但必须要透过蓝色的钴玻璃观察到紫色火焰,故答案为:焰色反应;透过蓝色的钴玻璃观察到紫色火焰;②标况下1.12L一氧化氮的物质的量为:n(NO)=1.12L/22.4L/mol=0.05mol,生成0.05mol电子需要转移的电子的物质的量为:(5-2)×0.05mol=0.15mol,根据电子守恒,如果固体完全为铁,则固体的质量为:56gmol×=2.8g;如果固体为FeO,则固体的质量为:72g/mol×0.15mol/3−2=10.8g,所以4.4g为Fe和FeO的混合物,Fe与硝酸反应的离子方程式为:3FeO+NO3-+10H+═3Fe3++5H2O+NO↑,FeO与硝酸反应的离子方程式为:Fe+NO3-+4H+═Fe3++2H2O+NO↑,故答案为:Fe和FeO;3FeO+NO3-+10H+═3Fe3++5H2O+NO↑、Fe+NO3-+4H+═Fe3++2H2O+NO↑.
考查方向
解题思路
探究无水三草酸合铁酸钾K3[Fe(C2O4)3]受热分解的产物:连接好装置后,加入药品前,应该进行的实验操作是检验装置气密性,利用氮气提供惰性环境,避免干扰分解产物的分析和验证,装置A:无水三草酸合铁酸钾K3[Fe(C2O4)3]受热分解,装置B:将气体产物通过澄淸石灰水,观察到澄清石灰水变浑浊,有CO2生成,装置C:用氢氧化钠将CO2除尽,装置D:净化(干燥)剩余产物气体,装置E:检验CO(用CuO,变红),装置F:检验有CO2生成(CO的氧化产物).①验证固体产物中钾元素存在的实验方法用焰色反应,但必须要透过蓝色的钴玻璃观察到紫色火焰来判断;②先根据n=V/Vm计算出NO的物质的量,再根据化合价变化计算出生成一氧化氮转移的电子的物质的量,然后利用极值法和电子守恒判断4.4g固体的组成,最后写出反应的离子方程式.
易错点
元素及其化合物性质、离子方程式书写等知识
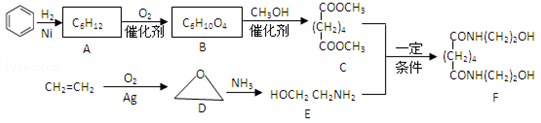
11.有机物F是一种新型涂料固化剂,可由下列路线合成(部分反应条件略去):
(1)B的结构简式是__________;E中含有的官能团名称是___________.
(2)由C和E合成F的化学方程式是__________
(3)同时满足下列条件的苯的同分异构体的结构简式是__________.
①含有3个双键 ②核磁共振氢谱只显示1个吸收峰 ③不存在甲基
(4)乙烯在实验室可由_______ (填有机物名称)通过______(填反应类型)制备
(5)下列说法正确的是________.
a.A属于饱和烃 b.D与乙醛的分子式相同 c.E不能与盐酸反应 d.F可以发生酯化反应
正确答案
(1)HOOC(CH2)4COOH,羟基和氨基;
(2)CH3OOC(CH2)4COOCH3+2HOCH2CH2NH2
(3)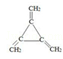
(4)乙烯在实验室可由乙醇通过消去反应制取,故答案为:乙醇,消去反应;
(5)abd.
解析
解析已在路上飞奔,马上就到!
知识点
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(假设杂质中不含铁元素和氧元素,且杂质不与稀硫酸反应)。某研究性学习小组对某铁矿石中铁的价态和氧化物的化学式进行探究。
[提出假设]
假设1:铁矿石中只含+3价铁;
假设2:铁矿石中只含+2价铁;
假设3:_____________________________________________。
[查阅资料]2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
11.[定性探究]
实验(一)
取铁矿石样品粉碎,盛装于烧杯中,加入适量的X溶液,微热,充分溶解后将滤液分成四份:
①向第一份溶液中滴加少量KSCN溶液;
②向第二份溶液中滴加适量高锰酸钾溶液;
③向第三份溶液中滴加少量KSCN溶液,再滴加适量过氧化氢溶液;
④向第四份溶液中滴加适量氢氧化钠溶液。
(1)上述X溶液是________(填“稀硝酸”“稀硫酸”或“浓盐酸”);上述方案中,一定能证明铁矿石中含+2价铁的方案是________(填序号)。
12.[定量探究]
实验(二) 铁矿石中含氧量的测定:
①按图组装仪器,检查装置的气密性;
②将5.0 g铁矿石放入硬质玻璃管中,其他装置中的药品如图所示(夹持装置已略去);
③A中开始反应,不断地缓缓向后续装置中通入氢气,待D装置出口处氢气验纯后,点燃C处酒精灯;
④充分反应后,撤掉酒精灯,再持续通入氢气直至完全冷却。
(2)按上述方案进行多次实验,假设各项操作都正确,但最终测得结果都偏高,请你提出改进方案的建议:____________________________________________________。
如果拆去B装置,测得结果可能会________(填“偏高”“偏低”或“无影响”)。
(3)改进方案后,测得反应后D装置增重1.35 g,则铁矿石中氧的百分含量为________。若将H2换成CO,则还需补充________装置。
13.实验(三) 铁矿石中含铁量的测定:
(4)步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、______________。
(5)步骤④中煮沸的作用是_________________________________________。
(6)若滴定过程中消耗0.500 0 mol·L-1的KI溶液20.00 mL,则铁矿石中铁的百分含量为________。
正确答案
铁矿石中含有+3价和+2价铁 (1分)(1)稀硫酸 (2分) ② (1分)
解析
样品溶解需要酸,硝酸具有氧化性可能也会亚铁离子,浓盐酸会被高锰酸钾溶液也会生成氯气,所以只有稀硫酸符合;依据实验步骤②,向第二份溶液中滴加适量高锰酸钾溶液具有强氧化性,加入高锰酸钾溶液褪色证明被还原,证明含有亚铁离子
考查方向
铁矿石中铁元素的价态确定
解题思路
样品溶解需要酸,硝酸具有氧化性可能也会亚铁离子,浓盐酸会被高锰酸钾溶液也会生成氯气,所以只有稀硫酸符合;依据实验步骤②加入高锰酸钾溶液褪色证明含有亚铁离子
易错点
溶解铁矿石酸的选择
教师点评
本题考查铁矿石中铁元素价态的确定,属于中等难度题目,有利于培养学生对于知识探究程序的掌握能力
正确答案
(2)D装置之后接一个装碱石灰的干燥管(或装浓硫酸的洗气瓶) (2分) 偏高 (2分)
(3)24% (2分) 尾气处理 (1分)
解析
(2)该实验中,氢气和氧化铁反应生成金属铁和水,根据固体质量的变化来计算铁的含量,分析装置图,最后碱石灰可以吸收空气中的水蒸气和二氧化碳导致测定结果偏高,需连接盛碱石灰的干燥管;去掉装置B水蒸气金融业装置D导致测定结果偏高
(3)依据水的质量计算含氧元素质量得到铁矿石中氧的百分含量,测的反应后装置D增重1.35g,根据反应的实质,增加的是水的质量,根据质量守恒定律,所以铁矿石中氧的百分含量是:

考查方向
氧元素的含量测定
解题思路
(2)分析装置图,最后碱石灰可以吸收空气中的水蒸气和二氧化碳导致测定结果偏高,需连接盛碱石灰的干燥管;去掉装置B水蒸气金融业装置D导致测定结果偏高;
(3)依据装置D中水的质量,结合氧元素守恒计算含氧元素质量,得到铁矿石中氧的百分含量
易错点
连接装置的作用
教师点评
本题考查了探究铁矿石中氧元素含量的方法,该题是高考中的常见题型,属于中等难度的试题,侧重对学生能力的培养和训练,有利于培养学生规范严谨的实验设计、操作能力
正确答案
(4)250mL容量瓶 (1分)
(5)赶走溶液中溶解的过量Cl2 (1分)
(6)70% (2分)
解析
(4)将原溶液稀释到250mL,需要使用的玻璃仪器仪器有:烧杯、玻璃棒、胶头滴管、250mL容量瓶,还缺少250mL容量瓶;
(5)向铁矿石中加入硫酸,化反应生成硫酸的铁盐溶液,还存在过量的硫酸溶液,加入过量的氯气,煮沸后可以降低氯气的溶解度,赶走溶液中溶解的过量的Cl2;
(6)根据反应的方程式为2Fe3++2I-=2Fe2++I2可知,消耗的碘离子与铁离子物质的量相等,n(Fe3+)=n(KI),即:0.5000mol•L-1×0.020L=c(Fe3+)×0.02L,解得c(Fe3+)=0.5mol•L-1,所以铁元素的百分含量为:
考查方向
铁元素的含量测定
解题思路
(4)根据稀释液体和配制一定体积的溶液的步骤所选择的仪器来回答主要是计算、量取、溶解、转移、洗涤转移、定容、摇匀等;
(5)煮沸可以将水中的气体赶走;
(6)根据元素守恒和化学反应方程式进行计算,根据反应的方程式为2Fe3++2I-=2Fe2++I2可知,消耗的碘离子与铁离子物质的量相等,n(Fe3+)=n(KI).
易错点
定量计算
教师点评
本题考查了探究铁矿石中铁元素的含量的方法,该题是高考中的常见题型,属于中等难度的试题,侧重对学生能力的培养和训练,有利于培养学生规范严谨的实验设计、操作能力
天然碱的组成可以用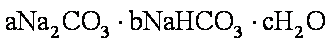
将质量为31.0 g的天然碱A于300℃加热分解至完全(300℃时Na2CO3不分解),产生CO2 2.24 L(标准状况)和水5.4 g。
(1)天然碱A的化学式中: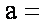
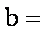
已知:Na2CO3与稀盐酸的反应分下列两步进行:
Na2CO3+HCl
将质量为12.45 g的天然碱B溶于水,逐滴滴加某浓度的稀盐酸,产生气体的体积与加入盐酸的体积(标准状况)的关系如下表所示:
(2)由表中数据可推测加入50mL盐酸时,产生气体的体积为 mL(标准状况);
盐酸的浓度为 mol/L;天然碱B的化学式为: 。
(3)若取一定质量的天然碱B加入到30mL该浓度的盐酸中,请写出产生气体体积V(mL,标准状况)与天然碱B质量W(g) 之间的关系式。
正确答案
(1)a=1,b=2,c=2
(2)1120mL(2分) ; 2.5mol/L ;2Na2CO3·NaHCO3 ·2H2O
(3),0g<W≤4.98g V=67200W/332 mL(或V=202.41WmL)
解析
略
知识点
扫码查看完整答案与解析