- 常见无机物及其应用
- 共1311题
9. 已知:2SO2 (g)+ O2(g) 
下列说法不正确的是
正确答案
知识点
11. 下表中“试剂”与“操作及现象”对应关系错误的是
正确答案
知识点
12.下图是电解
正确答案
解析
在电解池中,电流的流向和电子的移动方向相反,电流是从正极流向阳极,所以c是阳极,d是阴极,a是正极,b是负极.
A.阳极上氢氧根离子失电子生成氧气,阴极上氢离子得电子生成氢气,故A正确;
B.由分析可知,d为阴极.c为阳极,故B正确;
C.d极上氢离子得电子生成氢气,c极上氢氧根离子失电子生成氢离子,所以溶液的pH不会升高,故C错误;
D.电解过程中,阴离子向阴极移动,故D正确.
故选C。
考查方向
解题思路
在电解池中,电流的流向和电子的移动方向相反,电流是从正极流向阳极,所以c是阳极,d是阴极,a是正极,b是负极,据此分析.
易错点
不清楚电解池的工作原理,不会根据电子流向和电流流向判断电源的正负极,从而确定电极的阴阳极,缺乏分析能力.
知识点
4.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是()
正确答案
解析
A.自由移动的溴离子能和硝酸银溶液反应生成淡黄色沉淀,往溴乙烷中滴入硝酸银溶液,振荡,没有沉淀,说明溴乙烷中不含溴离子,故A正确;B.能和氯化钡反应生成白色沉淀的离子可能是硫酸根离子或银离子,向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成,溶液中可能含有硫酸根离子,也可能含有银离子,故B错误;C.硫酸是强酸、硫化氢是弱酸,硫酸铜和硫化氢反应生成不溶于稀硫酸的CuS,故C错误;D.将铝箔用坩埚钳夹住放在酒精灯火焰上加热,铝和氧气反应生成了氧化铝,形成氧化膜,三氧化二铝的熔点高于铝的熔点,包住了熔化的铝,所以加热铝箔的时候铝熔化了但是不会滴落,故D错误。
故选A
考查方向
解题思路
A.自由移动的溴离子能和硝酸银溶液反应生成淡黄色沉淀;B.能和氯化钡反应生成白色沉淀的离子可能是硫酸根离子或银离子;C.硫酸是强酸、硫化氢是弱酸;D.三氧化二铝的熔点高于铝的熔点,所以铝箔在酒精灯上加热到熔化,熔化的铝并不滴落.
易错点
对实验原理和操作方法理解和记忆不够透彻
知识点
7.下列说法正确的是
正确答案
解析
A.pH=2的H2C2O4溶液与pH=12的NaOH溶液等体积混合,根据电荷守恒可知:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-) +2c( C2O42-),A错误;
B.Na2S和ZnSO4反应有白色沉淀ZnS生成,Na2S和CuSO4反应有黑色沉淀CuS生成,5ml 0.1mol/LNa2S溶液明显过量,无法证明沉淀转化,则无法证明Ksp(ZnS)
C.在Na2HPO4水溶液中,根据物料守恒可知:存在关系式:2c(H3PO4)+2c(H2PO4-)+2c(HPO42-)+2c(PO43-)=c(Na+),C错误;
D.一定温度下,Kw=l×10-13,pH=8的NaOH溶液c(OH-)=10-5,pH=5的H2SO4溶液c(H+)=10-5,保持温度不变,欲使混合溶液pH=7,设NaOH溶液的体积为V1,H2SO4溶液的体积为V2,(10-5V1-10-5V2)/(V1+V2)=10-6,V1:V2=11︰9,D正确。
故选D。
考查方向
解题思路
A.pH=2的H2C2O4溶液与pH=12的NaOH溶液等体积混合,根据电荷守恒可知;
B.5ml 0.1mol/LNa2S溶液明显过量,无法证明沉淀转化;
C.在Na2HPO4水溶液中,根据物料守恒可知;
D.注意水的浓度积常数的应用及pH计算。
易错点
本题考查较为综合,涉及离子浓度大小比较、盐类的水解、弱电解质的电离以及难溶电解质的溶解平衡等问题,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意相关基础知识的积累,难度中等。
知识点
6.下列有关海水综合利用的说法正确的是
正确答案
解析
A、溴元素在海水中以化合态存在,将元素由化合态转化为游离态时发生电子转移,所以一定发生氧化还原反应,生成溴单质然后,用有机萃取,故A错误;
B、钠易与水反应,电解饱和食盐水得到氢氧化钠、氯气和氢气,应用电解熔融的氯化钠的方法冶炼钠,故B错误;
C、蒸发是根据物质的沸点进行分离的操作,为物理变化,故C正确;
D、加入过量的氯水能将I2氧化成更高价的化合物,减少碘的产率,故D错误;
考查方向
物质的分离提纯和鉴别
解题思路
A、海水中提取溴单质,Br元素化合价由-1价变为0价;
B、电解饱和食盐水得到氢氧化钠、氯气和氢气;
C、蒸发为物理变化;
D、加入过量的氯水能将I2氧化成更高价的化合物
易错点
D项中过量氯气可将I-氧化为更高价态的化合物
教师点评
本题考查了海水资源的开发和利用,侧重于化学与生活、生产的考查,有利于培养学生良好的科学素养,根据基本概念结合物质转化方式来分析解答,知道从海水中提取溴的方法,题目难度不大
知识点
17.室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是
正确答案
解析
混合溶液的pH=7,说明溶液中c(H+)=c(OH-);
A.向0.10mol•L-1CH3COONa溶液中通入HCl,至溶液pH=7,c(H+)=c(OH-),HCl不足,反应后溶液中溶质为NaCl、醋酸和醋酸钠,由电荷守恒可知,c(Na+)=c(CH3COO-)+c(Cl-),由物料守恒可知,c(Na+)=c(CH3COOH)+c(CH3COO-),则c(Na+)>c(CH3COOH)=c(Cl-),故A正确;
B.溶液中钠离子与S原子物质的量之比为1:1,而铵根离子与部分亚硫酸根结合,故c(Na+)>c(NH4+),由物料守恒可知,c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3),溶液呈中性,由电荷守恒可得:c(Na+)+c(NH4+)=2c(SO32-)+c(HSO3-),联立可得:c(NH4+)+c(H2SO3)=c(SO32-),故B错误;
C.向0.10mol•L-1Na2SO3溶液通入SO2,发生Na2SO3+SO2+H2O=2NaHSO3,至溶液pH=7,反应后溶液中溶质为的NaHSO3、Na2SO3,则c(Na+)<2[c(SO32-)+c(HSO3-)+c(H2SO3)],故C错误;
D.溶液中存在电荷守恒,根据电荷守恒得c(NH4+)=c(HCO3-)+2c(CO32-),故D错误;
考查方向
离子浓度大小比较
解题思路
混合溶液的pH=7,说明溶液中c(H+)=c(OH-);
A.向0.10mol•L-1CH3COONa溶液中通入HCl,至溶液pH=7,反应后溶液中溶质为NaCl、醋酸和醋酸钠;
B.溶液中钠离子与S原子物质的量之比为1:1,而铵根离子与部分亚硫酸根结合,由物料守恒可知,c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3),溶液呈中性,由电荷守恒可得:c(Na+)+c(NH4+)=2c(SO32-)+c(HSO3-),联立判断;
C.未反应前结合物料守恒可知c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)],向0.10mol•L-1Na2SO3溶液通入SO2,至溶液pH=7,反应后溶液中溶质为NaHSO3、Na2SO3;
D.溶液中存在电荷守恒,根据电荷守恒判断
易错点
溶液中的电荷守恒、物料守恒
教师点评
本题考查离子浓度大小比较,明确盐类水解、弱电解质的电离及物质之间发生的反应是解本题关键,注意题给信息的灵活运用,会正确运用守恒解答问题,题目难度不大
知识点
4.下列说法错误的是
正确答案
解析
A.液化石油气的主要成分是丙烷、丙烯、丁烷、丁烯等,都属于烃,故A正确;
B.光化学烟雾是排入大气的碳氢化合物和氮氧化物等一次污染物在阳光(紫外光)作用下发生光化学反应生成二次污染物,是一种有毒烟雾,故B正确;
C.无论甲烷是否正四面体结构,CHCl3都不存在同分异构体,可根据CH2Cl2是否存在同分异构体判断,故C错误;
D.二氧化碳因含量大,为导致温室效应的主要气体,甲烷也可导致温室效应,尤为严重,故D正确
考查方向
有机物的结构和性质;常见的生活环境的污染及治理
解题思路
A.液化石油气的主要成分为丙烷、丙烯、丁烷、丁烯等;
B.光化学烟雾与氮氧化物、烃的排放有关;
C.无论甲烷是否正四面体结构,CHCl3都不存在同分异构体;
D.二氧化碳、甲烷都可导致温室效应
易错点
C项中甲烷结构的判断
教师点评
本题考查有机物的结构和性质以及污染问题,综合性较强,把握常见污染问题、物质的组成、有机物的组成、结构的核心为解答的关键,题目难度不大
知识点
19.一定温度下,向某密闭容器中以物质的量1:1冲入适量X(g)和Y,发生可逆反应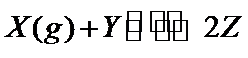

正确答案
解析
根据可逆反应X(g)+Y
考查方向
化学平衡
解题思路
扩大一倍容积,平衡时X的浓度不变,说明,减小压强时,平衡向生成X的方向移动,根据此分析解答
易错点
扩大容积相当于浓度减小,体积扩大一倍时等效于浓度减小一倍
教师点评
本题考查化学平衡的影响因素,题目难度不大
知识点
6.用NA表示阿佛加德罗常数,下列有关水的说法正确的是
正确答案
解析
A、标况下水为液体,故不能根据气体摩尔体积来计算其物质的量和分子个数,故A错误;
B、9g水的物质的量为0.5mol,而1mol水中含10mol电子,故0.5mol水中含5NA个电子,故B错误;
C、18g重水的物质的量为0.9mol,而1mol重水中含10mol中子,故0.9mol重水中含9NA个中子,故C错误;
D、23g酒精的物质的量为0.5mol,而酒精为非电解质、在水溶液中不能电离,故所得溶液中溶质的微粒个数为0.5NA个,故D正确
考查方向
阿伏加德罗常数
解题思路
A、标况下水为液体;
B、求出水的物质的量,然后根据1mol水中含10mol电子来分析;
C、求出重水的物质的量,然后根据1mol重水中含10mol中子来分析;
D、求出酒精的物质的量,然后根据酒精为非电解质、在水溶液中不能电离来分析
易错点
A项中水为液态
教师点评
本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大
知识点
12.已知热化学方程式:2SO2(g)+O2(g)
正确答案
解析
A、反应是可逆反应不能进行彻底,在容器中充入2mol SO2和1mol O2充分反应,最终放出的热量小于196.6kJ,故A错误;
B、催化剂只能改变反应所需的活化能,不能改变焓变,故B错误;
C、在接触法制硫酸中,通常不采用低温或者很大压强的方式来提高三氧化硫的产率,因为低温反应速率慢,高压对设备要求高,成本高,而实际的转化率变化很小,故C正确;
D、工业生产中,在吸收塔内用98.3%的浓硫酸吸收SO3.不能直接用水吸收,因为容易形成酸雾且吸收效率低,故D错误
考查方向
化学反应中的能量变化;化学平衡
解题思路
A、反应是可逆反应不能进行彻底;
B、热化学方程式的焓变是指对应化学方程式量全部完全反应放出的热量,与催化剂无关;
C、低温反应速率慢,高压对设备要求高,成本高,而实际的转化率变化很小;
D、工业生产中,在吸收塔内用98.3%的浓硫酸吸收SO3
易错点
A项中可逆反应的反应热
教师点评
本题考查了热化学方程式和焓变的关系分析、化学平衡移动与实际生产生活的联系,理解应用是解题关键,题目难度中等
知识点
2.分类是化学研究的重要方法,下列物质分类错误的是
正确答案
解析
A.干冰为二氧化碳、明矾为硫酸铝钾、烧碱为氢氧化钠,都是纯净物中的化合物,故A正确;
B.石墨、C60、金刚石都是碳的单质属于碳元素的同素异形体,故B正确;
C.乙醇、四氯化碳属于非电解质,氯气是单质既不是电解质也不是非电解质,故C错误;
D.漂白粉是氯化钙和次氯酸钙的混合物、纯净矿泉水是含电解质的水属于混合物、盐酸是氯化氢气体的水溶液属于混合物,故D正确;
考查方向
物质的分类
解题思路
A.不同元素主持词的纯净物为化合物;
B.同种元素组成的不同单质互称为同素异形体;
C.水溶液中和熔融状态下都不导电的化合物为非电解质;
D.不同物质组成的为混合物
易错点
D项纯净矿泉水是混合物
教师点评
本题考查了物质分类、物质组成的分析判断,主要是概念的内涵和外延的理解应用,题目较简单
知识点
17. 将一定体积的CO2缓慢地通入V L NaOH溶液中,已知NaOH完全反应,若在反应后的
溶液中加入足量石灰水,得到a g沉淀;若在反应后的溶液中加入足量CaCl2溶液,得
到b g沉淀,则下列说法正确的是
正确答案
解析
根据Na2CO3+CaCl2═CaCO3↓+2NaCl,NaHCO3与CaCl2不反应,但碳酸钠、碳酸氢钠都与石灰水反应生成碳酸钙沉淀,已知NaOH完全反应,则一定体积的CO2通入V L NaOH溶液中产物为碳酸钠或碳酸钠和碳酸氢钠;
A.因a、b的关系不确定,无法计算参加反应的CO2的体积,故A错误;
B.由A选项可知若a=b,则CO2与NaOH溶液反应生成的盐只有Na2CO3,故B正确;
C.若产物为碳酸钠,碳酸钠与石灰水、CaCl2溶液都能反应生成碳酸钙,则a=b;若产物为碳酸钠和碳酸氢钠,碳酸氢钠与CaCl2溶液不反应,碳酸钠与CaCl2溶液反应生成碳酸钙,但碳酸钠、碳酸氢钠都与石灰水反应生成碳酸钙沉淀,则a>b,但不可能a<b,故C错误;
D.若a、b相等时,由Na2CO3+CaCl2═CaCO3↓+2NaCl~2NaOH可计算NaOH的物质的量,溶液的体积已知,则可以计算浓度,故D错误
考查方向
化学方程式的有关计算
解题思路
根据Na2CO3+CaCl2═CaCO3↓+2NaCl,NaHCO3与CaCl2不反应,但碳酸钠、碳酸氢钠都与石灰水反应生成碳酸钙沉淀,已知NaOH完全反应,则一定体积的CO2通入V L NaOH溶液中产物不确定,以此来解答
易错点
NaHCO3与CaCl2不反应,但能与Ca(OH)2反应形成沉淀
教师点评
本题考查学生利用化学反应方程式的计算,明确发生的化学反应并准确判断a、b的关系是解答本题的关键,题目难度中等
知识点
18.关于下列各装置图的叙述中,正确的是
正确答案
解析
A、煤油比水轻,可以隔离空气中的氧气避免生成的氢氧化亚铁被氧化,观察到白色沉淀的生成,故A正确;
B、碳酸钠受热的温度更高却没分解,导气管通入澄清石灰水不变浑浊,碳酸氢钠试管的连接的导气管通入澄清石灰水变浑浊,说明受热条件下碳酸钠比碳酸氢钠稳定,故B正确;
C、加热氯化铵受热分解生成的氯化氢和氨气在试管口处重新结合为氯化铵,得到不到氨气,故C错误;
D、分离沸点不同且互溶的液体混合物,温度计水银球需要在导气管口处,不能插入混合液中,故D错误;
考查方向
物质性质实验
解题思路
A、煤油比水轻,可以隔离空气中的氧气避免生成的氢氧化亚铁被氧化;
B、据题意碳酸钠受热不易分解,碳酸氢钠受热易分解,及装置特点和二氧化碳能使澄清的石灰水变浑浊分析解答;
C、加热氯化铵受热分解生成的氯化氢和氨气在试管口处重新结合为氯化铵;
D、依据蒸馏分离混合物的依据是物质的沸点不同进行分离的实验方法,温度计测定馏出成分的沸点,温度计水银球需要在导气管口处
易错点
D项蒸馏时温度计水银球应在导气管处
教师点评
本题考查了物质性质实验验证的装置分析判断,主要是物质性质的应用,掌握基础是关键,题目难度中等
知识点
4. 下列解释事实的方程式不正确的是
正确答案
解析
A.二氧化氮与水反应生成硝酸是硝酸型酸雨的形成的原因,反应的化学方程式为:3NO2+H2O═2HNO3+NO,故A正确;
B.用Fe2(SO4)3做净水剂,利用的是铁离子的水解,反应的离子方程式为:Fe3++3H2O⇌Fe(OH)3+3H+,故B正确;
C.水垢中的CaSO4用Na2CO3溶液处理,硫酸钙不能拆开,正确的离子方程式为:CaSO4+CO32-═CaCO3+SO42-,故C错误;
D.向5 mL 0.1mol•L-1的K2Cr2O7溶液中滴加5滴浓硫酸,Cr2O72-的水解程度减小,溶液橙色变深,反应的离子方程式为:Cr2O72-(橙色)+H2O⇌2CrO42-(黄色)+2H+,故D正确;
考查方向
离子方程式书写
解题思路
A.二氧化氮与水反应生成硝酸和一氧化氮气体;
B.硫酸铁电离出的铁离子发生水解生成氢氧化铁胶体,氢氧化铁胶体能够净水;
C.水垢中的硫酸钙在离子方程式中不能拆开;
D.滴入浓硫酸后,溶液中氢离子浓度增大,抑制了重铬酸根离子的水解
易错点
难溶物、弱电解质等需要保留化学式
教师点评
本题考查了离子方程式的书写判断,为高考的高频题,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等
知识点
扫码查看完整答案与解析












