- 常见无机物及其应用
- 共1311题
7.为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
下列说法不正确的是
正确答案
知识点
3.下列有关物质的性质与用途具有对应关系的是( )
正确答案
解析
A、SO2用于漂白纸浆是利用其漂白性,错误;B、NH4HCO3用作氮肥是因为其中含有氮元素,易被农作物吸收,错误;C、Fe2(SO4)3用作净水剂是因为铁离子水解生成氢氧化铁胶体,吸附水中悬浮的杂质,错误;D、Al2O3熔点高,可用作耐高温材料,正确。
考查方向
解题思路
Al2O3和MgO的熔点高,均可用作耐高温材料。
易错点
主要是A项,不能理解二氧化硫的化学性质的多样性。
知识点
2.下列物质见光不会分解的是( )
正确答案
解析
【解析】HClO见光分解为HCl与氧气,故A不选;氯化铵加热分解生成氨气和HCl,见光不分解,故B选;硝酸见光分解为二氧化氮、氧气与水,故C不选;硝酸银见光分解Ag、二氧化氮、氧气,故D不选; 故选B.
考查方向
解题思路
浓硝酸、硝酸银、次氯酸见光都易分解;而氯化铵加热分解,见光不分解,以此来解答.
易错点
本题考查物质的性质,为高频考点,综合考查元素化合物知识,侧重物质稳定性的考查,注意反应条件为光照,题目难度不大.
知识点
15.(NH4)2SO4在一定条件下发生如下反应


正确答案
解析
反应后的混合气体通入到BaCl2溶液中发生的是复分解反应
SO2+H2O+2NH3=(NH4)2SO3 (NH4)2SO3+BaCl2=BaSO3↓+2NH4Cl
SO3+H2O+2NH3 =(NH4)2SO4 (NH4)2SO4+BaCl2=BaSO4↓+2NH4Cl
依据反应定量关系,结合分解生成的气体物质的量可知,二氧化硫转化为亚硫酸铵,1mol三氧化硫转化为硫酸铵消耗氨气2mol,则4mol氨水和2mol二氧化硫反应生成亚硫酸铵,所以得到的沉淀为1mol硫酸钡,2mol亚硫酸钡,剩余二氧化硫和亚硫酸钡反应生成亚硫酸氢钡,最后得到沉淀为1mol硫酸钡,1mol亚硫酸钡。
故选A。
考查方向
解题思路
根据反应生成的产物量和性质分析,二氧化硫溶于水和水反应生成亚硫酸,三氧化硫溶于水和水反应生成硫酸,氨气溶于水生成一水合氨,硫酸和氯化钡反应生成硫酸钡沉淀,亚硫酸和氨水反应生成亚硫酸铵,所以通入氯化钡溶液中,关键分解反应生成的气体物质的量进行计算分析判断,最后得到沉淀为1mol硫酸钡,1mol亚硫酸钡。
易错点
本题考查了物质反应的定量计算及物质性质的综合应用,关键是分析反应过程反应判断沉淀生成的实质,题目难度中等。
知识点
6.下列实验中
正确答案
解析
A.干燥管中的白色粉末先变成天蓝色说明有水产生,后又变成深蓝色,说明有氨气产生;
B.硝B.由于硝酸可以将SO32-氧化为SO42-;以及与BaCl2产生白色沉淀的溶液中还可能含有Ag+所以向某无色溶液中滴加硝酸酸化的BaCl2溶液,产生白色沉淀,原溶液中还可能含有SO32-或者还可能含有Ag+,故B错误;
C.CuS不溶于硫酸,所以向CuSO4溶液中通入H2S气,溶液的蓝色褪去,生成了黑色CuS沉淀,但是不能说明氢硫酸的酸性比硫酸强,所以C错误;
D.向2ml0.1mol/LAgNO3溶液中先滴了几滴0.1mol/L的NaCl溶液,由于NaCl用量不足,所以在这个反应过程中Ag+没有消耗完,所以再滴入几滴0.1mol/L的NaI溶液时,剩余的Ag+可以与I-发生反应所以不能说明溶度积KSp(AgCl)>KSp(AgI),D错误;
考查方向
解题思路
A.干燥管中的白色粉末先变成天蓝色说明有水产生,继续加热后又变成深蓝色,说明有氨气产生,所以可以说明加热温度较低时摩尔盐分解产生水蒸气,温度稍高时分解产物中有氨气,A正确;
B.硝酸可以将SO32-氧化为SO42-;以及与BaCl2产生白色沉淀的溶液中还可能含有Ag+;
C.CuS不溶于硫酸,所以向CuSO4溶液中通入H2S气,溶液的蓝色褪去,生成黑色CuS沉淀;
D.向2ml0.1mol/LAgNO3溶液中先滴了几滴0.1mol/L的NaCl溶液,由于NaCl用量不足,所以在这个反应过程中Ag+没有消耗完,所以再滴入几滴0.1mol/L的NaI溶液时,剩余的Ag+可以与I-发生反应;
易错点
A.不了解无水硫酸铜变成深蓝色的反应原理;
B.忽略硝酸可以将SO32-氧化为SO42-;以及与BaCl2产生白色沉淀的溶液中还可能含有Ag+
C.不了解CuS不溶于硫酸;
D.忽略量的关系致错。
知识点
碳酸氢铵是一种重要的铵盐。实验室中,将二氧化碳通入氨水可制得碳酸氢铵,用碳酸氢铵和氯化钠可制得纯碱。
完成下列填空:
(1)二氧化碳通入氨水的过程中,先有__晶体(填写化学式)析出,然后晶体溶解,最后析出NH4HCO3晶体。
(2)含0.800 mol NH3的水溶液质量为54.0 g,向该溶液通入二氧化碳至反应完全,过滤,得到滤液31.2g,则NH4HCO3的产率为____%。
(3)粗盐(含Ca2+、Mg2+)经提纯后,加入碳酸氢铵可制得碳酸钠。实验步骤依次为:
①粗盐溶解;
②加入试剂至沉淀完全,煮沸;
③______;
④加入盐酸调pH;
⑤加入______;
⑥过滤;
⑦灼烧,冷却,称重。
(4)上述步骤②中所加入的试剂为__、__。
(5)上述步骤④中加盐酸调pH的目的是__。
(6)为探究NH4HCO3和NaOH的反应,设计实验方案如下:
含0.1 mol NH4HCO3的溶液中加入0.1 mol NaOH,反应完全后,滴加氯化钙稀溶液。
若有沉淀,则NH4HCO3与NaOH的反应可能为_____(写离子方程式);
若无沉淀,则NH4HCO3与NaOH的反应可能为______(写离子方程式)。
该实验方案有无不妥之处?若有,提出修正意见。
正确答案
(1)(NH4)2CO3 ;
(2) 92%;
(3)过滤、碳酸氢铵
(4)氢氧化钠、碳酸钠 ;
(5)中和过量的氢氧化钠和碳酸钠 ;
(6) HCO3-+OH-→CO32-+H2O、NH4++OH-→NH3+H2O 需先煮沸,然后滴加氯化钙稀溶液
解析
(1)将CO2通入氨水中首先生成(NH4)2CO3晶体析出,随CO2不断通入,(NH4)2CO3和CO2作用转化为NH4HCO3晶体,最终析出NH4HCO3晶体。
(2)该氨水完全反应需通入0.8molCO2,过滤得到m(NH4HCO3)=54.0g+0.8mol×44g·mol-1-31.2g=58g,理论上应得到m(NH4HCO3)=0.8mol×79g·mol-1=63.2g,故实验NH4HCO3的产率为:58g/63.2g=92%。
(3)粗盐提纯步骤应是向粗盐溶液中加入沉淀剂、过滤(除去沉淀),然后加入盐酸,调PH(除去前面加入沉淀剂引入的OH-与CO32-),此时溶液为纯净的NaCl溶液,再向该溶液中加入碳酸氢铵,即可析出溶解度较小的碳酸氢钠,然后过滤、洗涤得到纯净NaHCO3,将NaHCO3加热得到Na2CO3。
(4)步骤2中加入沉淀剂为NaOH(用来除去Mg2+)、碳酸钠(用来除去Ca2+)。
(6)因向NH4HCO3溶液中加入NaOH时,发生的离子反应有:HCO3-+OH-=CO32-+H2O与NH4++OH-=NH3·H2O,若NaOH量不足,则两反应存在先后次序问题,故实验中若产生沉淀,说明反应后溶液中含有CO32-,证明先发生HCO3-+OH-=CO32-+H2O,否则先发生NH4++OH-=NH3·H2O。
知识点
化学与社会生活密切相关。对下列现象或事实的解释正确的是
正确答案
解析
略
知识点
在水溶液中能大量共存的一组是
正确答案
解析
略
知识点
将反应 4(NH4)2SO4→ N2↑+6NH3↑+3SO2↑+SO3↑+7H2O 的产物气体通入BaCl2溶液,下列判断正确的是 ()
正确答案
解析
略
知识点
9.(NH4)2SO4是常见的化肥和化工原料,受热易分解。某兴趣小组拟探究其分解产物。
[查阅资料] (NH4)2SO4在2600C和4000C时分解产物不同。
[实验探究]该小组拟选用下图所示装置进行实验(夹持和加热装置略)
实验1:连接装置A-B-C-D,检查气密性,按图示加入试剂(装置B盛0.5000mol/L盐酸70.00mL)。通入N2排尽空气后,于2600C加热装置A一段时间,停止加热,冷却,停止通入N2。品红溶液不褪色,去下装置B,加入指示剂,用0.2000mol/LNaOH溶液滴定剩余盐酸,终点时消耗NaOH溶液25.00Ml。经检验滴定后的溶液中无SO42-.
(1)仪器X的名称是________________.
(2)滴定前,下列操作的正确顺序是_________(填字母编号)。
a. 盛装0.2000mol/LNaOH溶液
b. 用0.2000mol/LNaOH溶液润洗
c. 读数、记录
d. 查漏、清洗
e. 排尽滴定管尖嘴的气泡并调整液面
(3)装置B内溶液吸收气体的物质的量是__________mol
实验2:连接装置A-D-B,检查气密性,按图示重新加入试剂。通入N2排尽空气后,与4000C加热装置A至(NH4)2SO4完全分解无残留物,停止加热,冷却,停止通入N2.观察到装置A、D之间的导气管内有少量白色固体。经检验,该白色固体和装置D内溶液中有SO32-,无SO42。进一步研究发现,气体产物中无氮氧化物。
(4)检验装置D内溶液中有SO32-,无SO42-的实验操作和现象是__________.
(5)装置B内溶液吸收的气体是____________.
(6)(NH4)2SO4在4000C分解的化学方程式是______________________.
正确答案
(1)圆底烧瓶
(2)dbaec
(3)0.03
(4)取少量装置D内溶液于试管中,滴加BaCl2溶液,生成白色沉淀;加入足量稀盐酸后沉淀完全溶解,放出无色刺激性气体
(5)NH3或氨气
(6)3(NH4)2SO4
解析
解析已在路上飞奔,马上就到!
知识点
研究含氮、碳化合物的性质对它们的综合利用有重要意义。
23.反应NO+O3=NO2+O2,若生成11.2 L O2(标准状况)时,转移电子的物质的量是
Mol

已知:2SO2(g)+O2(g)

写出N
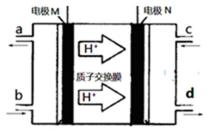
25.N2H4(肼或联氨)燃料电池(产生稳定、无污染的物质)原理如图所示。M电极发生的电极反应式为
26.已知CO (g) +H

①一定条件下反应达到平衡状态后,若改变反应的某个条件,下列变化能说
A.逆反应速率先增大后减小
B.H2 O (g)的体积百分含量减小
C.CO的转化率增大
D.容器中c(CO2)/c(CO)的值减小
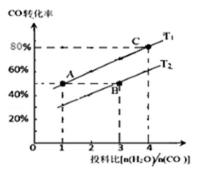
②在某压强下,上述反应在不同温度、不同投料比时, CO的转化率如图所示。则KA、KB、KC三者之间 的大小关系为 T1温度下,将1molCO和4mol H2O (g)充入2L的密 闭容器中,5min后反应达到平衡状态,则0~5min 内的
正确答案
1
解析
NO+O3═NO2+O2,生成1mol氧气转移电子是2mol,生成11.2L即0.5mol O2(标准状况)时,转移电子的物质的量是1mol,故答案为:1;
考查方向
解题思路
化合价升高值=化合价降低值=转移电子数,根据化合价的变化来确定电子转移数目;
易错点
利用化学平衡计算与影响因素、盖斯定律的应用对图象分析提取信息。
正确答案
2NO(g)+O2(g) = 2NO2(g) ΔH=-113.0 kJ/mol
解析
已知:A、NO2(g)+SO2(g)=SO3(g)+NO(g)△H=﹣41.8kJ•mol﹣1;
B、2SO2(g)+O2(g)=2SO3(g)△H=﹣196.6kJ•mol﹣1,则反应:2NO(g)+O2(g)=2NO2(g)可以看成是B﹣2A得到的,所以该反应的△H=﹣196.6kJ•mol﹣1﹣2(﹣41.8kJ•mol﹣1)=﹣113.0 kJ•mol﹣1,故答案为:2NO(g)+O2(g)=2NO2(g)△H=﹣113.0 kJ•mol﹣1;
考查方向
解题思路
A、NO2(g)+SO2(g)=SO3(g)+NO(g)△H=﹣41.8kJ•mol﹣1;B、2SO2(g)+O2(g)=2SO3(g)△H=﹣196.6kJ•mol﹣1,则反应:2NO(g)+O2(g)=2NO2(g)可以看成是B﹣2A得到的,根据盖斯定律结合热化学方程式的书写来回答;
易错点
利用化学平衡计算与影响因素、盖斯定律的应用对图象分析提取信息。
正确答案
N2H4-4e-=N2↑+4H+
解析
由氢离子的移动方向可知,M区为负极,发生的电极反应式为N2H4﹣4e﹣=N2↑+4H+,故答案为:N2H4﹣4e﹣=N2↑+4H+;
考查方向
解题思路
由氢离子的移动方向可知,M区为负极,发生失电子的氧化反应;
易错点
利用化学平衡计算与影响因素、盖斯定律的应用对图象分析提取信息。
正确答案
① C
② KA= KC >KB 0.08mol·L-1·min-1 
解析
①A.逆反应速率先增大后减小,可能是增大生成物浓度,平衡逆向移动,故A错误;
B.H2O(g)的体积百分含量减小,可能是增大生成物浓度,平衡不一定正向移动,故B错误;
C.CO的转化率增大,平衡正向移动,故C正确;
D.容器中的二氧化碳和氢气浓度比值变小,可能是减小二氧化碳的物质的量,平衡逆向移动,故D错误,
故选:C;
②平衡常数仅与温度有关,温度不变,平衡常数不变,所以KA=KC,反应是吸热反应,所以升高温度,平衡正向移动,CO的转化率增加,T2<T1,温度越高,K越大,所以KA=KC>KB,T1温度下,将1molCO和4mol H2O (g)充入2L的密闭容器中,5min后反应达到平衡状态,此时CO的转化率是80%,则0~5min内的平均反应速率v(CO)=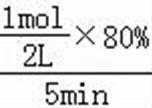
此时K=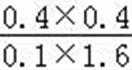
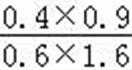
故答案为:0.08mol•L﹣1•min﹣1;>.
考查方向
解题思路
①A.逆反应速率先增大后减小,可能是增大生成物浓度;
B.H2的转化率增大,平衡一定正向移动;
C.反应物的体积百分含量减小,可能是增大生成物浓度等;
D.容器中的二氧化碳和氢气浓度比值变小,可能是减小二氧化碳的物质的量.
②根据平衡常数仅与温度有关,温度不变,平衡常数不变,T1温度下,根据平均反应速率v(CO)=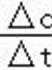
易错点
利用化学平衡计算与影响因素、盖斯定律的应用对图象分析提取信息。
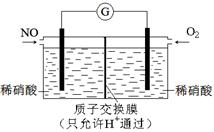
利用下图所示装置进行下列实验,能得出相应实验结论的是
正确答案
解析
略
知识点
下列试剂中,标签上应标注

正确答案
解析
略
知识点
下列实验能达到目的的是
正确答案
解析
A:两者密度都比水小,均发生萃取,溴水层褪色。B.两者都有沉淀生成。C.两者均能与NaHCO3溶液反应,而且引入CO2.
知识点
下列实验“操作和现象”与“结论”对应关系正确的是
正确答案
解析
向Fe(NO3)2溶液中加入H2SO4,则会发生离子反应:3Fe2++NO3- +4H+=3Fe3++NO↑+2H2O,产生的NO在管口生成NO2呈现红色,而不是HNO3分解产生NO2,故A项错误。应加入碱将水解后的淀粉溶液调节成碱性,才可以产生红色沉淀,B项错误。乙醇和浓硫酸反应制取乙烯的过程中,会有少量的SO2产生,也可以使酸性KMnO4溶液褪色,C项错误。饱和Na2CO3溶液中通入CO2发生反应:Na2CO3+CO2+H2O=2NaHCO3,由于产生的碳酸氢钠溶解度小于碳酸钠,故会从过饱和溶液中析出,D项正确。
知识点
扫码查看完整答案与解析