- 常见无机物及其应用
- 共1311题
14.25℃时,下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13.如下图,在25℃,101.3KPa下,将10mLO2全部压入左端盛有20mLN0的注射器中充分反应。以下对压入O2后左端注射器中的气体描述错误的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
25.Ⅰ.向FeCl3溶液中加入铁粉和铜粉混合粉末,充分反应后,下列情况可能存在的是 (填序号)
Ⅱ.今有一包铁粉和铜粉混合粉末,为确定其组成,现提供4mol/L的FeCl3,溶液(其他用品略),某课外活动小组同学的实验结果如下(假定反应前后溶液体积不变)。
(1)试判断第④组剩余固体质量x为___________。第①组实验中,发生反应的离子方程式为 _____________________。
(2)试判断第②组剩余固体的成分为_________________。
(3)原混合粉末中Fe.Cu的物质的量之比为____________________。
正确答案
Ⅰ. ②③⑥⑦
Ⅱ.
(1) 0 2Fe3++ Fe=3Fe2+
(2) Cu
(3) 6﹕1
解析
解析已在路上飞奔,马上就到!
知识点
硫在自然界中以游离态和多种化合态形成出现。硫的化合物大多具有氧化性或还原性。许多金属硫化物难溶于水。
完成下列填空:
(1)硫化氢具有还原性,可以和许多氧化剂反应。在酸性条件下,H2S和KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式。_________________________________
(2)石油化工的废气中有H2S。写出从废气中回收单质硫的两种方法(除空气外,不使用其他原料),以化学方程式表示。_____________________、______________________
(3)室温下,0.1mol/L的硫化钠溶液和0.1mol.L的碳酸钠溶液,碱性更强的是_______,其原因是________。
已知:H2S:Ki1=1.3×10-7 Ki2=7.1×10-15
H2CO3:Ki1=4.3×10-7 Ki2=5.6×10-11
(4)向ZnSO4溶液中滴加饱和H2S溶液,没有沉淀生成,继续滴加一定量的氨水后,生成ZnS沉淀。用电离平衡原理解释上述现象。__________________________
(5)将黑色的Fe2S3固体加入足量盐酸中,溶液中有淡黄色固体生成,产物还有____、______。过滤,微热滤液,然后加入过量的氢氧化钠溶液,可观察到的现象是______________。
正确答案
答案:(1)3H2SO4+5H2S+2KMnO4→5S↓+2Mn SO4+K2 SO4+8H2O
(2)2H2S+3O2
2SO2+2 H2O, 2H2S+SO2→3S+2 H2O;H2S
S+H2或2 H2S+ O2
2S+2 H2O
(3)硫化钠溶液;硫化氢的Ki2小于碳酸的Ki2,硫化钠更易水解。
(4)饱和H2S溶液中电离产生的S2-很少,因此没有沉淀。加入氨水后,促进H2S电离,S2-离子浓度增大,有沉淀产生。
(5)FeCl2 、H2S ;先有白色沉淀生成,然后沉淀转化为灰绿色,最终转化为红褐色。
解析
略
知识点
硫有多种含氧酸,亚硫酸(H2SO3)、硫酸(H2SO4)、焦硫酸(H2SO4·SO3)、硫代硫酸(H2S2O3)等等,其中硫酸最为重要,在工业上有广泛的应用。在实验室,浓硫酸是常用的干燥剂。
完成下列计算:
(1)焦硫酸(H2SO4·SO3)溶于水,其中的SO3都转化为硫酸。若将445g焦硫酸溶于水配成4.00L硫酸,该硫酸的物质的量浓度为________mol/。
(2)若以浓硫酸吸水后生成的H2SO4·H2O计算,250g质量分数为98%的硫酸能吸收多少g水?
(3)硫铁矿是工业上制硫酸的主要原料。硫铁矿氧化焙烧的化学反应如下:
3FeS2+8O2→Fe3O4+6SO2 4FeS2+11 O2→2Fe2O3+8SO2
若48mol FeS2完全反应耗用氧气2934.4L(标准状况),计算反应产物中Fe3O4与Fe2O3物质的量之比。
(4)用硫化氢制取硫酸,既能充分利用资源又能保护环境,是一种很有发展前途的制备硫酸的方法。
硫化氢体积分数为0.84的混合气体(H2S、H2O、N2)在空气中完全燃烧,若空气过量77%,计算产物气体中SO2体积分数(水是气体)。(已知空气组成:N2体积分数0.79、O2体积分数0.21)
正确答案
答案: (1) 1.25
(2) 250×98%÷98×14=40g
(3) 2934.4÷22.4=131mol 设Fe3O4 amol Fe2O3 bmol
3a+2b=48 8a+11÷2b=131 a=4 b=18
n(Fe3O4):n(Fe2O3)=2:9
(4)设混合气体为1体积,0.84体积硫化氢完全燃烧生成0.84体积二氧化硫和0.84体积水,消耗1.26体积氧气。
所需空气为1.26÷0.21×1.77=10.62体积
φ(SO2)=0.84÷(10.62-1.26+1.84)=0.075
解析
略
知识点
和氢硫酸反应不能产生沉淀的是
正确答案
解析
本题考查元素化合物知识,意在考查考生对化学反应的知识掌握的再现能力。A项能生成PbSO4沉淀;C项生成CuS沉淀;D项因发生氧化还原反应生成单质硫沉淀,故正确答案为:B。
知识点
最近我国学者发现,以精CuFeS2矿为原料在沸腾炉中和O2(空气)反应,生成物冷却后经溶解、除铁、结晶,得到CuSO4·5H2O,实验结果如下:
下列关于这一过程的叙述错误的是( )
正确答案
解析
略
知识点
水是生命之源,万物之基,是人类最宝贵的自然资源
(1)我国规定水质各种指标的主要要求为:a.不得呈现异色:b.不得有异味:C.水应澄清透明:d,不得含有细菌和病毒。前两项指标可以利用活性炭的____作用来实现:后两项指标可以通过加入消毒剂、絮凝剂反应、沉降,然后通过_____(填操作名称)来实现
(2)我国规定饮用水的硬度不超过25度硬度的表示方法是:将水中的



(3)某地下水的硬度是由Ca(HC03)2所引起的,下列方法中能够使之软化的是_____
正确答案
解析
略
知识点
下列与生活相关的叙述错误的是
正确答案
解析
略。
知识点
将通有H2S的导气管伸入充满氧气的集气瓶内点燃,描述反应过程的曲线错误的是()
正确答案
解析
略
知识点
16. 研究大气中含硫化合物(主要是SO2和H2S)的转化具有重要意义。
(1)高湿条件下,写出大气中SO2转化为HSO3-的方程式:_____________。
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图如下:
1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为______________________。
(3)二氧化硫—空气质子交换膜燃料电池可以利用大气所含SO2快速启动,其装置示意图如下:
①质子的流动方向为___________(“从A到B”或“从B到A”)。
②负极的电极反应式为______________________ 。
(4)燃煤烟气的脱硫减排是减少大气中含硫化合物污染的关键。SO2烟气脱除的一种工业流程如下:
①用纯碱溶液吸收SO2将其转化为HSO3-,反应的离子方程式是______________________。
②若石灰乳过量,将其产物再排回吸收池,其中可用于吸收SO2的物质的化学式是___________。
正确答案
(1)SO2 + H2O 

(2)H2S(g) + 2O2(g) = SO42-(aq) + 2H+(aq) ΔH = -806.39 kJ·mol-1
(3)①从A到B ② SO2 – 2e- + 2H2O == SO42- + 4H+
(4)① H2O + 2SO2 + CO32- == 2HSO3- + CO2↑ ② NaOH [多写Ca(OH)2不扣分]
解析
(1)高湿条件下SO2转化为HSO3-的过程即为SO2与水反应生成H2SO3;SO2 + H2O 

由两步反应的能量变化示意可以看出,H2S先被氧化为S(g)释放能量,H2S(g)+0.5O2(g)===S(g)+H2O(g) ΔH = -221.19 kJ·mol-1,然后再S被进一步氧化为 SO42-(aq)释放能量:S(g)+1.5O2(g)+H2O(g)===SO42-(aq) + 2H+(aq) ΔH = -585.20 kJ·mol-1,所以1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式就可以根据盖斯定律完成;将两个热方程式相加:H2S(g) + 2O2(g) = SO42-(aq) + 2H+(aq) ΔH = -806.39 kJ·mol-1
(3)①由于该装置为原电池,且SO2为还原剂失去电子作负极,O2氧化剂得到电子作正极,而质子带正电荷,在原电池中带正电荷的阳离子向正极移动;所以质子的流动方向为从A到B;②由于SO2作负极失去电子,在溶液中一定会生成SO42-,即电极反应式为: SO2 – 2e- + 2H2O == SO42- + 4H+
(4)①由于H2SO3酸性比H2CO3酸性强,所以用纯碱溶液吸收SO2,H2SO3可以将纯碱转化为 CO2, 反应的离子方程式为:H2O + 2SO2 + CO32- == 2HSO3- + CO2↑;②若石灰乳过量,则其产物中有生成的NaOH ,所以再排回吸收池,其中可用于吸收SO2的物质的物质就为NaOH 。
考查方向
通过大气中含硫化合物的转化过程,考查弱电解质的电离平衡、热方程式的书写、电极反应、离子方程式的书写、尾气的处理等中学化学主干知识。
解题思路
(1)高湿条件下SO2转化为HSO3-的过程即为SO2与水反应生成H2SO3,然后再发生电离;
由两步反应的能量变化示意可以看出,H2S(g)先被氧化为S(g)释放能量,
(2)然后再被进一步氧化为 SO42-(aq)释放能量,所以1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式就可以根据盖斯定律完成;
(3)由于该装置为原电池,且SO2为还原剂失去电子作负极,O2氧化剂得到电子作正极,而质子带正电荷,在原电池中带正电荷的阳离子向正极移动;由于SO2作负极失去电子,在溶液中一定会生成SO42-
(4)由于H2SO3酸性比H2CO3酸性强,所以用纯碱溶液吸收SO2,H2SO3可以将纯碱转化为 CO2,若石灰乳过量,则其产物中有生成的NaOH ,所以再排回吸收池,其中可用于吸收SO2的物质的物质就为NaOH。
易错点
多元弱酸的分步电离;书写热方程式要注意物质状态以及焓变值要与系数对应;电极反应、离子方程式的书写都要遵循守恒规律。
知识点
12.与氢硫酸反应有沉淀生成的电解质是( )
正确答案
解析
电解质是在水溶液中或熔融状态下能导电的化合物,包括酸、碱、盐、金属氧化物和水.
CuS不溶于水也不溶于酸,故CuSO4能和H2S反应生成CuS沉淀: CuSO4+H2S=CuS↓+H2SO4,且硫酸铜为电解质,故A正确;
H2S和NaOH发生酸碱中和反应:H2S+2NaOH=Na2S+H2O,无沉淀生成,故B错误;
FeS不溶于水但溶于酸,故FeSO4和H2S不能反应,故C错误;
SO2和H2S发生归中反应有硫单质生成:SO2+2H2S=3S↓+2H2O,但二氧化硫不是电解质,故D错误.
故选A.
考查方向
解题思路
CuS不溶于酸; H2S和NaOH发生酸碱中和反应;FeS不溶于水但溶于酸;
SO2和H2S发生归中反应.
易错点
本题考查了电解质的概念以及复分解反应发生的条件,难度不大,应注意的是FeS不溶于水但溶于酸,故FeSO4和H2S不能反应.
知识点
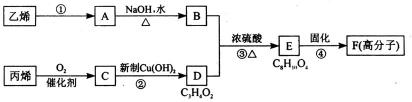
17.以石化产品乙烯、丙烯为原料合成厌氧胶的流程如下。
关于该过程的相关叙述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
用于金属焊接的某种焊条,其药皮由大理石、水泥、硅铁等配制而成。
(1)Al的原子结构示意图为________;Al与NaOH溶液反应的离子方程式为________________________________________________________________________。
(2)30Si原子的中子数为________;SiO2的晶体类型为____________。
(3)Al3+与Yn-的电子数相同,Y所在族各元素的氢化物的水溶液均显酸性,则该族元素的氢化物中沸点最低的是________。
(4)焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是________。
(5)经处理后的熔渣36.0 g(仅含Fe2O3、Al2O3、SiO2),加入足量稀盐酸,分离得到11.0 g固体;滤液中加入过量NaOH溶液,分离得到21.4 g固体;则此熔渣中Al2O3的质量分数为________。
正确答案
(1) 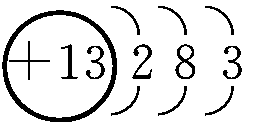
(2)16;原子晶体
(3)HCl
(4)CO2
(5)25%
解析
本题考查元素化合物的性质及物质结构与性质。
(1)铝的原子结构示意图为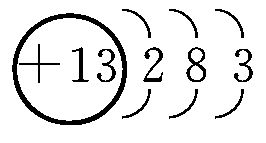
(2)中子数等于质量数减去质子数,因此30Si的中子数为16,二氧化硅为原子晶体;
(3) 由Y所在的族各元素的氢化物的水溶液均显酸性,则Y位于第ⅦA族,Y为氟元素,该族元素的氢化物均为分子晶体,相对分子质量越大,沸点越高,但HF分子间存在氢键,沸点较HCl高,故沸点最低的为HCl;
(4)根据药皮的成分确定焊接过程中产生的气体为二氧化碳;
(5)加入足量稀盐酸,分离得到的固体为SiO2,即m(SiO2)=11.0g,21.4 g固体为氢氧化铁,其物质的量为=0.2 mol,由铁原子守恒可确定n(Fe2O3)=0.1 mol,m(Fe2O3)=16.0 g,进而求出 m(Al2O3)=9.0 g,ω(Al2O3)=×100%=25%。
知识点
下面关于SiO2晶体网状结构的叙述正确的是
正确答案
解析
二氧化硅是原子晶体,结构为空间网状,存在硅氧四面体结构,硅处于中心,氧处于4个顶角所以A项错误;在SiO2晶体中,每6个Si和6个O形成一个12元环(最小环),所以D对,B、C都错误!
知识点
扫码查看完整答案与解析