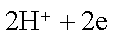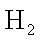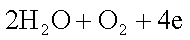- 常见无机物及其应用
- 共1311题
6.硅与某非金属元素X的化合物具有高熔点高硬度的性能,X一定不可能是( )
正确答案
解析
硅与某非金属元素X的化合物具有高熔点高硬度的性能,说明该晶体为原子晶体,可能为碳化硅,氮化硅,二氧化硅、而四氯化硅、四氟化硅为分子晶体,X一定不可能是ⅦA族元素,故选D
考查方向
元素周期律与元素周期表
解题思路
硅与某非金属元素X的化合物具有高熔点高硬度的性能,说明该晶体为原子晶体,可能为碳化硅,氮化硅,二氧化硅,以此来解答
易错点
能与硅形成的原子晶体的非金属元素找不全
教师点评
本题考查了原子晶体的性质,掌握常见的原子晶体是解题的关键
知识点
甲酸(HCOOH)是一种有刺激性气味的无色液体,有很强的腐蚀性、较强的还原性。熔点8.4℃,沸点100.7℃,能与水、乙醇互溶,加热至160℃ 即分解成二氧化碳和氢气。
14.实验室可用甲酸与浓硫酸共热制备一氧化碳:HCOOH浓硫酸
Ⅰ 制备CO Ⅱ Ⅲ 收集CO
①请从下图中挑选所需的仪器,补充图中虚线方框中缺少的气体发生装置:_______、e(填选项序号)(必要的塞子、玻璃管、橡胶管、固定装置已省略)。其中,温度计的水银球应该处于 位置。
② 装置Ⅱ 的作用是 。
15.实验室可用甲酸制备甲酸铜。其方法是先用硫酸铜和碳酸氢钠作用制得碱式碳酸铜,碱式碳酸铜再与甲酸反应制得四水甲酸铜[Cu(HCOO)2·4H2O]晶体。相关的化学方程式是:2CuSO4+4 NaHCO3= Cu(OH)2·CuCO3↓+3CO2↑+2Na2SO4+H2O Cu(OH)2·CuCO3+4HCOOH+ 5H2O=2 Cu(HCOO)2·4H2O+ CO2↑
实验步骤如下:
Ⅰ、碱式碳酸铜的制备:
Ⅱ、甲酸铜的制备: 将Cu(OH)2·CuCO3固

17.请设计实验证明甲酸具有较强的还原性: 。
正确答案
①a、c 
②防止水槽中的水因倒吸而流入蒸馏烧瓶中
解析
①该反应的制取原理为 液+液

② 生成的气体中含有CO、HCOOH和H2O,HCOOH易溶于水,会发生倒吸现象,需在收集前加一个安全瓶,故装置Ⅱ的作用是防止水槽中的水因倒吸流入蒸馏烧瓶中,故答案为:防止水槽中的水因倒吸流入蒸馏烧瓶中;
考查方向
解题思路
①该反应的制取原理为 液+液
② 生成的气体中含有CO、HCOOH和H2O,HCOOH易溶于水,会发生倒吸现象,需在收集前加一个安全瓶;
易错点
本题考查了化学实验装置的综合应用,题目难度中等,明确实验目的及发生反应的原理为解答关键,只有掌握化学实验装置的特点及综合应用方法,试题培养了学生的化学实验能力。
正确答案
①研细并混合均匀
②出现黑色固体
③取最后一次洗涤液少许于试管中,滴加BaCl2溶液,若不产生白色沉淀,说明沉淀已洗涤干净;若产生白色沉淀,说明沉淀未洗涤干净。
④防止甲酸铜晶体析出
⑤洗去晶体表面的水和其它杂
解析
①因为是取混和固体多次加入热水中,故两种固体要混合均匀,而NaHCO3固体和CuSO4·H2O晶体均易结成块,固要研细才可混和均匀;
②氢氧化铜和碳酸铜受热均不稳定易分解,前者生成黑色的氧化铜和水,后者者黑色的氧化铜和二氧化碳,所以温度过高会使它们分解,出现黑色固体,说明温度过高;
③步骤ⅱ的后续操作有过滤、洗涤(洗去硫酸根离子),检验沉淀是否已洗涤干净的方法为取最后一次洗涤液少许于试管中,滴加BaCl2溶液,若不产生白色沉淀,说明沉淀已洗涤干净;若产生白色沉淀,说明沉淀未洗涤干净。
④蒸发浓缩后甲酸铜的浓度比较高,如果冷却至常温会以晶体的形式析出,故要“趁热”过滤;
⑤将滤液冷却结晶后,析出的晶体表面一定会残留有溶液中的其它物质,如表面上有水,还有一些其它的溶质都有可能残留在上面,故用乙醇洗涤晶体的目的是洗去晶体表面的水和其它杂质;
考查方向
解题思路
①因为是取混和固体多次加入热水中,故两种固体要混合均匀;
②氢氧化铜和碳酸铜受热均不稳定易分解,出现黑色固体,说明温度过高;
③检验沉淀是否已洗涤干净的方法为取最后一次洗涤液少许于试管中,滴加BaCl2溶液,若不产生白色沉淀,说明沉淀已洗涤干净;若产生白色沉淀,说明沉淀未洗涤干净。
④蒸发浓缩后甲酸铜的浓度比较高,如果冷却至常温会以晶体的形式析出,故要“趁热”过滤;
⑤用乙醇洗涤晶体的目的是洗去晶体表面的水和其它杂质;
易错点
本题考查了化学实验装置的综合应用,题目难度中等,明确实验目的及发生反应的原理为解答关键,只有掌握化学实验装置的特点及综合应用方法,试题培养了学生的化学实验能力。
正确答案
往甲酸溶液中滴加氢氧化钠溶液调成碱性。再取该溶液几滴滴加到2mL新制银氨溶液中,水浴加热,有银镜生成。
解析
甲酸含有醛基,醛基有还原性,设计如下实验证明甲酸具有较强的还原性:往甲酸溶液中滴加氢氧化钠溶液调成碱性。再取该溶液几滴滴加到2mL新制银氨溶液中,水浴加热,有银镜生成。
考查方向
解题思路
甲酸含有醛基,醛基有还原性,设计如下实验证明甲酸具有较强的还原性。
易错点
本题考查了化学实验装置的综合应用,题目难度中等,明确实验目的及发生反应的原理为解答关键,只有掌握化学实验装置的特点及综合应用方法,试题培养了学生的化学实验能力。
28.硫是一种生命元素,组成某些蛋白质时离不开它。SO2是硫的一种重要氧化物,为探究SO2的性质,某化学兴趣小组的同学设计了如下系列实验:
(1)为验证SO2具有还原性。将SO2气体通入溴水中,溴水褪色。写出反应的化学方程式
__________________________。
(2)已知与SO2 Na2O2的反应,为进一步探究Na2O2与SO2的反应,用如图所示装置进行实验。
① 写出A中反应的化学方程式__________________________。
② B装置的作用是_______________。
③ 在F处检验到有O2生成,据此甲同学认为Na2O2与SO2发生了反应,反应的化学方程式为
__________________________。
④乙同学认为Na2O2与SO2反应除生成Na2SO3和O2外,还有Na2SO4生成,为检验是否有Na2SO4生成,他们设计了如下实验方案。.
上述方案_________(“合理”或“不合理”),简要说明理由_________。
⑤E装置中溶液呈碱性,为检验吸收液中其他阴离子,完成下列实验方案。
正确答案
(1) SO2 + Br2 + 2H2O = H2SO4 + 2HBr
(2)
① H2SO4 + Na2SO3 = Na2SO4 + SO2↑ + H2O
②干燥吸水
③2Na2O2+ 2SO2 = 2Na2SO3+O2
④不合理
稀硝酸能将亚硫酸钡氧化为硫酸钡,如果反应后的固体中还残留Na2O2,它溶于水也能将亚硫酸根氧化成硫酸根
⑤取步骤I中白色沉淀于试管中,加入过量的稀盐酸
吸收液中存在SO32一和SO42一
解析
解析已在路上飞奔,马上就到!
知识点
50℃时,下列各溶液中,离子的物质的量浓度关系正确的是
正确答案
解析
略
知识点
月球的矿产资源极为丰富,仅月球表层5 cm厚的沙土就含铁单质有上亿吨,月球上的主要矿物有辉石CaMgSi2O6、斜长石CAlSi3O8和橄榄石(Mg或Fe)2SiO4等,下列说法或分析不正确的是
正确答案
解析
略
知识点
化学与环境、科学、技术密切相关。下列有关说法中正确的是
正确答案
解析
试题分析:A垃圾要分类处理,A错误;光导纤维是二氧化硅,是无机物,B错误;汽车尾气排出的NO、NO2等氮氧化物在光照条件下容易形成光化学污染物,C正确;合金的特点是熔点低、硬度大,D错误;故选C。
知识点
“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用。如可利用NaOH溶液来“捕捉”CO2,其基本过程如下图所示(部分条件及物质未标出)。下列有关该方法的叙述中正确的是
正确答案
解析
由题可知基本过程中有两个反应:①二氧化碳与氢氧化钠反应,②碳酸钙的高温分解。A选项正确,循环利用的应该有CaO和NaOH两种物质,B选项错误;“反应分离”过程中分离物质的操作应该是过滤,C选项错误;D选项中甲醇工业上可用CO2制备。
知识点
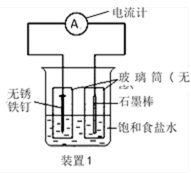
关于下图装置的叙述中正确的是
正确答案
解析
略
知识点
Fe2O3、ZnO、CuO的固体混合粉末
正确答案
解析
略
知识点
1.化学与社会、生活密切相关。对下列现象或事实的解释正确的是
正确答案
解析
A.化铝受热分解生成水,并吸收大量的热,是周围环境温度降低,且生成的氧化铝熔点高,附着在可燃物表面,从而阻止可燃物燃烧,故A错误
B. 二氧化硅是酸性氧化物,常温下能够与氢氟酸反应,故B错误
C. 过氧化钠与二氧化碳反应,生成碳酸钠和氧气,过氧化钠既作氧化剂又做还原剂,故C错误
D. 乙烯是一种植物生长调节剂,对水果蔬菜具有催熟的作用,乙烯含有不饱和键能被高锰酸钾氧化,故D正确。
故本题选D。
考查方向
解题思路
A.氢氧化铝受热分解生成水,并吸收大量的热,是周围环境温度降低
B.二氧化硅是酸性氧化物,常温下能够与氢氟酸反应
C.过氧化钠与二氧化碳反应,生成碳酸钠和氧气,过氧化钠既作氧化剂又做还原剂
D.乙烯是一种植物生长调节剂,对水果蔬菜具有催熟的作用
易错点
过氧化钠用于呼吸面具中作为氧气的来源,反应中过氧化钠既作氧化剂又做还原剂
知识点
1.漆器是中华民族传统工艺的瑰宝,常以木材(炭)、金属为胎骨,在胎骨上层层髹红漆。漆的主要成分是含有15或17个碳原子的烷基邻苯二酚。下列说法不正确的是( )
正确答案
解析
A.酚类化合物容易被空气中的氧气氧化,收藏漆器工艺品应注意避免阳光暴晒,A正确;
B.钻石和漆器中的木炭均由碳元素组成,B正确;
C.掉漆后铜长时间放置,会和空气中的氧气、二氧化碳和水反应生成铜绣,C错误;
D.漆的烷基部分是憎水基团,碳原子数越多越难溶于水,D正确。
故选C。
考查方向
解题思路
A.酚类化合物容易被空气中的氧气氧化;
B.钻石和木炭均由碳元素组成;
C.铜长时间放置,会和空气中的氧气、二氧化碳和水反应生成铜绣;
D.烷基部分是憎水基团,碳原子数越多越难溶于水。
易错点
本题解题的关键是掌握有机化合物的烷基部分碳原子数越多越难溶解于水。
知识点
13.已知:2C(s)+O2(g)=2CO(g) ΔH=-217kJ·mol-1C(s)+H2O(g)=CO(g)+H2(g) ΔH=b kJ·mol-1H-H、O-H和O=O键的键能分别为436、462和495kJ·mol-1,则b为
正确答案
解析
由已知可知2C(s)+2H2O(g)=2CO(g)+2H2(g) ΔH=2b kJ·mol-1,再与2C(s)+O2(g)=2CO(g)ΔH=-217kJ·mol-1相减,得到:2H2(g) + O2(g) =2H2O(g) ΔH=-217-2b kJ·mol-1 ,由于ΔH=反应物总键能 - 生成物总键能,可知:-217-2b = 2*436 + 495 - 4*462。
考查方向
解题思路
先写出目标方程式,ΔH=反应物总键能 - 生成物总键能。
易错点
盖斯定律的应用。
知识点
CO2和CH4均为温室气体,若得以综合利用,对于温室气体的整治具有重大意义。
14.已知:CO2(g) + CH4(g) 



15.合成甲醇的主要反应是CO(g)+2H2(g) 


①该反应属于 (填“吸”或“放”)热反应;P1 P2(填“>”、“<”或“=”)。200℃时,该反应的平衡常数K= (用含b的代数式表示)。
②若200℃时,上述反应经过tmin达到平衡,则该时间段内氢气的平均反应速率为 。
16.以渗透于多孔基质的惰性导电物质材料为电极,用35%~50%KOH为电解液,甲烷和空气为原料,构成碱性燃料电池,该电池负极的电极反应式为________
17.以甲烷燃料电池做电源,用如图所示装置,在实验室 中模拟铝制品表面“钝化”处理的过程中,发现溶液 逐渐变浑浊,用离子方程式表示沉淀产生的原因是 。
18.已知25℃时,Al( OH)3的Ksp=8.0×10 -33。若使某铝盐溶液中的Al3+降至1.0×10-6 mol.L-l时,则需调节溶液的pH至 (已知lg5=0.7)。
正确答案
△H < 0,所以在一定条件下能自发反应
解析
已知:CO2(g) + CH4(g) 



考查方向
解题思路
在一定温度下,当△G=△H-T•△S<0时反应可自发进行。
易错点
1、根据影响化学平衡的因素进行判断得出正确结论.升高温度,平衡向着吸热的方向移动;增大压强,平衡向着气体体积减小的方向移动.
2、电极方程式的书写。
正确答案
① 放 < 4/b2 ② b/2t mol/L .min-1
解析
图中压强p1<p2,x轴表示温度,y轴表示CO转化率,则相同压强下,温度越高,CO转化率越小,故升高温度,平衡逆向移动,所以该反应为放热反应;相同温度时,压强越大,CO转化率越高,则增大压强,平衡正向移动。
考查方向
解题思路
图中压强p1<p2,x轴表示温度,y轴表示CO转化率,则相同压强下,温度越高,CO转化率越小,故升高温度,平衡逆向移动,所以该反应为放热反应;相同温度时,压强越大,CO转化率越高,则增大压强,平衡正向移动。
易错点
1、根据影响化学平衡的因素进行判断得出正确结论.升高温度,平衡向着吸热的方向移动;增大压强,平衡向着气体体积减小的方向移动.
2、电极方程式的书写。
正确答案
CH4 —8e— +10OH— === CO32— +7H2O
解析
燃料在负极上失电子发生氧化反应,甲烷燃烧能生成二氧化碳和水,二氧化碳和氢氧化钾反应生成碳酸钾,所以电极反应式为:CH 4 +10OH - -8e - ═CO 3 2- +7H 2 O;
考查方向
本题主要考查了体积百分含量随温度、压强变化曲线.
解题思路
燃料在负极上失电子发生氧化反应;
易错点
1、根据影响化学平衡的因素进行判断得出正确结论.升高温度,平衡向着吸热的方向移动;增大压强,平衡向着气体体积减小的方向移动.
2、电极方程式的书写。
正确答案
Al 3+ + 3HCO3— ===Al(OH)3 ↓ +3CO2 ↑(2分)
解析
以甲烷燃料电池做电源,用如图所示装置,在实验室中模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,沉淀产生的原因是Al 3+和3HCO3—发生酸水解。 Al3+ + 3HCO3— =Al(OH)3 ↓ +3CO2 ↑;
考查方向
解题思路
Al 3+和3HCO3—发生酸水解。
易错点
1、根据影响化学平衡的因素进行判断得出正确结论.升高温度,平衡向着吸热的方向移动;增大压强,平衡向着气体体积减小的方向移动.
2、电极方程式的书写。
正确答案
5.3
解析
溶液中Al3+物质的量浓度(mol/L)和OH-物质的量浓度(mol/L)3次方为Al(OH)3的溶度积常数,Ksp=8.0×10 -33,当Al3+物质的量浓度(mol/L)和OH-物质的量浓度(mol/L)3次方的乘积小于1.0×10-6 mol.L-l时,溶液中不产生沉淀,以此计算OH-物质的量浓度.
考查方向
解题思路
当Al3+物质的量浓度(mol/L)和OH-物质的量浓度(mol/L)3次方的乘积小于1.0×10-6 mol.L-l时,溶液中不产生沉淀,以此计算OH-物质的量浓度.
易错点
1、根据影响化学平衡的因素进行判断得出正确结论.升高温度,平衡向着吸热的方向移动;增大压强,平衡向着气体体积减小的方向移动.
2、电极方程式的书写。
10. I.“低碳经济”时代,科学家利用“组合转化”等技术对CO2进行综合利用。
(1)CO2和H2在一定条件下可以生成乙烯:
6H2(g)+2CO2(g)
已知:H2(g)的燃烧热为285.8 kJ·mol-1,CH2=CH2(g)的燃烧热为1411.0 kJ·mol-1,H2O(g)=
(2)上述生成乙烯的反应中,温度对C
①温度越高,催化剂的催化效率越高
②温度低于250℃时,随着温度升高,乙烯的产率增大
③M点平衡常数比N点平衡常数大
④N点正反应速率一定大于M点正反应速率
⑤增大压强可提高乙烯的体积分数
(3)2012年科学家根据光合作用原理研制出“人造树叶”。右图是“人造树叶”的电化学模拟实验装置图,该装置能将H2O和CO2转化为O2和有机物C3H8O。
阴极的电极反应式为:_________________________
II.为减轻大气污染,可在汽车尾气排放处加装催化转化装置,反应方程式为:
2NO(g)+2CO(g)
(4)上述反应使用等质量的某种催化剂时,温度和催化剂的比表面积对化学反应速率的影响对比实验如下表,c(NO)浓度随时间(t)变化曲线如下图:
①表中a=___________。
②实验说明,该反应是__________反应(填“放热”或“吸热”)。
③若在500℃时,投料
(5)使用电化学法也可处理NO的污染,装置如右图。已知电解池阴极室中溶液的pH在4~7之间,写出阴极的电极反应式:_____________。吸收池中除去NO的离子方程式为:__________________________________。
正确答案
(1)-39.8
(2)① ② ④
(3)3CO2+18H++18e-=C3H8O+5H2O
(4)① 1.20×10-3
② 放热
③主要有三种情况:
第一种情况:设c(NO)=1mol·L-1 ,则K=160
第二种情况:设c(NO)=amol·L-1 ,则K=
第三种情况:设n(NO)=amol,容器的容积为V L,则K=
(5)2HSO3-+2H++2e-=S2O42-+2H2O
2NO+2S2O42-+2H2O=N2+4HSO3-
解析
I.(1)已知:H2(g)的燃烧热为285.8 kJ·mol-1,CH2=CH2(g)的燃烧热为1411.0 kJ·mol-1,H2O(g)=
①H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ/mol;
②CH2=CH2(g)+3O2(g)=2H2O(l)+2CO2 (g) △H=-1411.0kJ/mol;
③H2O(g)=
则利用盖斯定律将6①-②-4③可得:
6H2(g)+2CO2(g)
(2)①温度在250℃时,催化剂的催化效率最高,错误;
②温度低于250℃时,随着温度升高,乙烯的产率减小,错误;
③M点二氧化碳的平衡转化率比N点大,平衡常数比N点平衡常数大,正确;
④该反应是放热反应,温度升高,向逆反应方向进行,N点正反应速率一定小于M点正反应速率,错误;
⑤增大压强,反应向正反应方向进行,可提高乙烯的体积分数,正确。
故选①②④。
(3)阴极发生还原反应,阴极的电极反应式为:3CO2+18H++18e-=C3H8O+5H2O;
II.(4)①验证温度对化学反应速率的影响规律时,要确保其他条件相同而只有温度不同的情况下比较。验证催化剂的比表面积对化学反应速率的影响规律时,要确保其他条件相同而只有催化剂的比表面积不同的情况下比较。由于I与II的催化剂比表面积不同,所以,其他的量必须相同,即a=1.20×10-3;又因为I与III的温度不同,要确保其他条件相同,因此b=82;
②从图示可见,I和III催化剂比表面积相同,温度不同,III温度比I温度高,NO转化率降低,升高温度反应向逆反应方向进行,该反应是放热反应;
③若在500℃时,投料
2NO(g)+2CO(g)
起始浓度(mol/L) 1 1 0 0
转化浓度(mol/L) 0.8 0.8 0.8 0.4
平衡浓度(mol/L) 0.2 0.2 0.8 0.4
则此温度时的平衡常数K=(0.82×0.4)/(0.22×0.22)=160
第二种情况:设c(NO)=amol·L-1 ,则K=
第三种情况:设n(NO)=amol,容器的容积为V L,则K=
(5)电解池阴极室中溶液的pH在4~7之间,阴极发生还原反应,电极反应式:2HSO3-+2H++2e-=S2O42-+2H2O;吸收池中除去NO的离子方程式为:2NO+2S2O42-+2H2O=N2+4HSO3-。
考查方向
解题思路
I.(1)已知:H2(g)的燃烧热为285.8 kJ·mol-1,CH2=CH2(g)的燃烧热为1411.0 kJ·mol-1,H2O(g)=
①H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ/mol;
②CH2=CH2(g)+3O2(g)=2H2O(l)+2CO2 (g) △H=-1411.0kJ/mol;
③H2O(g)=
则利用盖斯定律将6①-②-4③可得:
6H2(g)+2CO2(g)
(2)①温度在250℃时,催化剂的催化效率最高;
②温度低于250℃时,随着温度升高,乙烯的产率减小;
③M点二氧化碳的平衡转化率比N点大,平衡常数比N点平衡常数大;
④该反应是放热反应,温度升高,向逆反应方向进行,N点正反应速率一定小于M点正反应速率;
⑤增大压强,反应向正反应方向进行,可提高乙烯的体积分数。
(3)阴极发生还原反应,阴极的电极反应式为:3CO2+18H++18e-=C3H8O+5H2O;
II.(4)①验证温度对化学反应速率的影响规律时,要确保其他条件相同而只有温度不同的情况下比较。验证催化剂的比表面积对化学反应速率的影响规律时,要确保其他条件相同而只有催化剂的比表面积不同的情况下比较。
②从图示可见,I和III催化剂比表面积相同,温度不同,III温度比I温度高,NO转化率降低,升高温度反应向逆反应方向进行,该反应是放热反应;
③若在500℃时,投料
2NO(g)+2CO(g)
起始浓度(mol/L) 1 1 0 0
转化浓度(mol/L) 0.8 0.8 0.8 0.4
平衡浓度(mol/L) 0.2 0.2 0.8 0.4
则此温度时的平衡常数K=(0.82×0.4)/(0.22×0.22)=160
第二种情况:设c(NO)=amol·L-1 ,则K=
第三种情况:设n(NO)=amol,容器的容积为V L,则K=
(5)电解池阴极室中溶液的pH在4~7之间,阴极发生还原反应,电极反应式:2HSO3-+2H++2e-=S2O42-+2H2O;吸收池中除去NO的离子方程式为:2NO+2S2O42-+2H2O=N2+4HSO3-。
易错点
该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生的逻辑推理能力。该题的关键是利用好化学平衡。
知识点
11.[化学—选修4物质结构与性质]
H2O和CS2分子中的原子都达到稳定结构。
(1)上述四种元素电负性由大到小的顺序是:___________________。
(2)上述四种元素第一电离能比同周期相邻两种元素都小的元素是:_______。
(3)CS2分子中

(4)用“大于”、“小于”或“等于”回答本问题:
①CS2在其晶体中的配位数_______H2O在其晶体中的配位数
②硫氰酸(H—S—C≡N)的熔点_____异硫氰酸(H—N=C=S)的熔点
(5)已知TiCl4熔点为37℃,沸点为136℃,熔融态不导电,可知TiCl4为____晶体。
(6)六方氮化硼(BN)的晶胞结构如右图所示。
①晶胞内的四个原子(如白球所示)所形成的空间结构为______形
②硼原子的杂化方式为_________。
③晶胞边长为a nm则其密度为____g·cm-3(设阿伏加德罗常数的值为NA)
正确答案
(1)O>S>C>H
(2)O、S
(3)1:1
(4)①大于
②小于
(5)分子
(6)①正四面体
② sp3
③
解析
(1)H、O、C、S四种元素中,非金属性越强,电负性越大,电负性由大到小的顺序是:O>S>C>H;
(2)因为VA族元素原子最外层p电子处于半充满状态,较稳定,第一电离能比同周期相邻两种元素都小的元素是VIA族元素原子:O、S;
(3)CS2分子结构与二氧化碳相似,有2个

(4)①CS2是分子晶体,只有范德华力,无分子间氢键-分子密堆积,每个分子周围有12个紧邻的分子,在其晶体中的配位数为12;H2O有分子间氢键-不具有分子密堆积特征,在其晶体中的配位数为4;CS2在其晶体中的配位数大于H2O在其晶体中的配位数;
②分子的极性越大,熔沸点越高,因此硫氰酸(H—S—C≡N)的熔点小于异硫氰酸(H—N=C=S)的熔点;
(5)TiCl4熔点为37℃,沸点为136℃,熔融态不导电且熔沸点较低,可知TiCl4为分子晶体;
(6)①晶胞内的四个原子(如白球所示),每两个原子之间距离相等,且是立体构型,所形成的空间结构为正四面体形;
②硼原子中心原子的价电子对数=(3+5)/2=4,杂化方式为sp3杂化。
③晶胞中原子数目分别为4,8×1/8+6×1/2=4,每个晶胞中原子的质量为(100/NA)g,晶胞边长为a nm,晶胞体积为(a×10-7m)3=a3×10-21m3,则其密度为g·cm-3(设阿伏加德罗常数的值为NA)。
考查方向
解题思路
(1)H、O、C、S四种元素中,非金属性越强,电负性越大;
(2)因为VA族元素原子最外层p电子处于半充满状态,较稳定,第一电离能比同周期相邻两种元素都小的元素是VIA族元素原子;
(3)CS2分子结构与二氧化碳相似,有2个

(4)①CS2是分子晶体,只有范德华力,无分子间氢键-分子密堆积,每个分子周围有12个紧邻的分子,在其晶体中的配位数为12;H2O有分子间氢键-不具有分子密堆积特征,在其晶体中的配位数为4;CS2在其晶体中的配位数大于H2O在其晶体中的配位数;
②分子的极性越大,熔沸点越高;
(5)熔融态不导电且熔沸点较低;
(6)①每两个原子之间距离相等,且是立体构型;
②硼原子中心原子的价电子对数=(3+5)/2=4,杂化方式为sp3杂化。
③晶胞中原子数目分别为4,8×1/8+6×1/2=4,每个晶胞中原子的质量为(100/NA)g,晶胞边长为a nm,晶胞体积为(a×10-7m)3=a3×10-21m3,则其密度为g·cm-3(设阿伏加德罗常数的值为NA)。
易错点
本题考查的知识点较多,难度较大,平时应该注意知识的积累。
知识点
扫码查看完整答案与解析