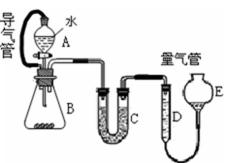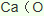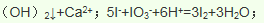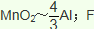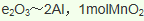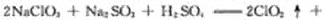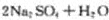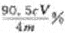- 常见无机物及其应用
- 共1311题
4.下列不正确的是()
正确答案
解析
根据离子的电荷守恒,c(Na+)+c(K+)+c(H+)=c(OH- )+c(CH3COO-)+c(Cl-),因为KCl是强电解质,因为c(K+)=c(Cl-),所以c(Na+)-c(CH3COO-)=c(OH-)-c(H+),故A正确;
相同浓度CH3COONa和NaClO的混合液中,CH3COOH较HClO的酸性强,因此CH3COO-较ClO-电离程度大,因此各离子浓度的大小关系是c(Na+)>c(CH3COO-)>c(ClO-)>c(OH-)>c(H+),故B错误;
如果HA是强酸,则消耗HA的溶液体积是10ml。如果HA弱酸,则消耗HA的溶液体积小于10ml,故C正确;
因为是恰好反应,所以产物恰好生成NH4Cl,即c(NH4+)+c(NH3•H2O)+c(NH3)=c(Cl- )=0.1/2=0.05mol/l,故D正确。
考查方向
解题思路
A:根据离子的电荷守恒,c(Na+)+c(K+)+c(H+)=c(OH- )+c(CH3COO-)+c(Cl-),因为KCl是强电解质,因此c(K+)=c(Cl-),所以c(Na+)-c(CH3COO-)=c(OH-)-c(H+);
B:相同浓度CH3COONa和NaClO的混合液中,CH3COOH较HClO的酸性强,因此CH3COO-较ClO-电离程度大,因此各离子浓度的大小关系是c(Na+)>c(CH3COO-)>c(ClO-)>c(OH-)>c(H+);
C:如果HA是强酸,则消耗HA的溶液体积是10ml。如果HA弱酸,则消耗HA的溶液体积小于10ml;
D:因为是恰好反应,所以产物恰好生成NH4Cl,即c(NH4+)+c(NH3•H2O)+c(NH3)=c(Cl- )=0.1/2=0.05mol/l
易错点
忽略溶液的酸碱性,对弱酸、弱碱的性质理解不够透彻
知识点
1.东汉魏伯阳在《周易参同契》中对汞的描述“……得火则飞,不见埃尘,将欲制之,黄芽为根。”这里的“黄芽”是指()
正确答案
解析
汞是唯一的液态金属,汞遇热能变成蒸气,变成蒸气不会落地成为颗粒状的物质,想要得到汞,用黄芽来提取。本题中是关于汞的物理性质与化学性质的考查。汞和金、铜、铁都不反应,唯独和硫能反应,生成HgS,HgS是难溶于水的固体物质,可以将散开的Hg变成固体聚集在一起,便于处理,所以,黄芽在这里指的就是硫,故本题选B。
考查方向
解题思路
题目中对汞的描述是:汞是唯一的液态金属。汞遇热能变成蒸气消失于人看不见的地方,变成蒸气不会落地成为颗粒状的物质,想要得到汞,用黄芽来提取。所以,本题中是关于汞的物理性质与化学性质的考查。汞和金、铜、铁都不反应,唯独和硫能反应,生成HgS,HgS是难溶于水的固体物质,可以将散开的Hg变成固体聚集在一起,便于处理,所以,本题选B。
易错点
对汞的化学性质与物理性质不了解,对生活中出现的化学元素物质陌生,理科生对文言文的描述理解有误,及文中提到的性质不能做出正确的推断
知识点
7. 下列根据实验操作和现象所得出的结论正确的是( )
正确答案
解析
A、有丁达尔效应的一定是胶体,硫的酒精溶液滴入一定量的热水中得微蓝色透明液体为胶体。
B、将FeSO4高温强热,得红色固体,产生的气体通入BaCl2溶液,SO2与BaCl2不能生成BaSO3。
C、乙烯不能使品红褪色,气体X可能是二氧化硫。
D、反应总是向着更难溶的方向进行,由于优先生成AgI,所以AgI的溶度积比AgCl小。
考查方向
解题思路
A.有丁达尔效应的一定是胶体,。
B.SO2与BaCl2不能生成BaSO3;
C.乙烯不能使品红褪色
D.反应总是向着更难溶的方向进行,由于优先生成AgI,所以AgI的溶度积比AgCl小
易错点
难溶电解质的沉淀转化本质。
知识点
13.常温下,下列溶液的离子浓度关系式正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
18.氯、溴、碘、钠、镁、锰、锂、铀等元素在海洋中被富集。海洋开发利用和维权是国家战略。
(1)以上元素在海水中的存在形态是__________(选填①游离态 ②化合态 ③不确定)
(2)以下变化属于化学变化的是______________________:
①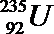
②重氢(2H)发生核聚变
③LiH做野外生氢剂
④海水晒盐
(3)由氯气和晒盐后的卤水制取液溴的离子方程式______________________________;由石灰乳和卤水沉淀出镁元素的离子方程式______________________________________;由海带灰可浸出KI,由某种矿盐可浸出KIO3,二者在盐酸中反应可生成碘单质,反应的离子方程式_________________________________。
(4)工业由氯化钠制取金属钠的化学方程式为__________________________________;工业制镁采用电解熔融氯化镁,不采用电解熔融氧化镁的原因是_________________________。
(5)海底富集多种矿物结核,锰结核是其中的一种。锰结核中主要含有MnO2和Fe2O3。一种质量比约为m(Mn):m(Fe)=55:448的合金钢(其它元素略),具有抗御激烈冲击和磨损的能力,可做航母甲板等。欲通过铝热反应炼得这样的合金,MnO2、Fe2O3、Al的投料比(按物质的量之比)约为______________。
正确答案
(1)氯、溴、碘、钠、镁、锰、锂、铀等元素在海洋中主要是以离子的形式存在,即是以化合态存在的,故答案为:②;
(2)LiH做野外生氢剂是有新物质生成的变化,属于化学变化,
 )发生核聚变、海水晒盐没有新物质生成,是物理变化,故答案为:③;
)发生核聚变、海水晒盐没有新物质生成,是物理变化,故答案为:③;(3)氯气具有氧化性,能将溴离子氧化为溴单质卤水制取液溴的离子方程式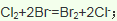
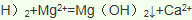
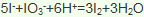
(4)金属钠是活泼金属,电解熔融的氯化钠可以制取金属钠:
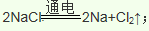
(5)质量比约为m(Mn):m(Fe)=55:448的合金钢中Mn元素和Fe元素的物质的量之比是1:8,根据原子守恒,投料MnO2、Fe2O3的物质的量之比是1:4,根据铝热反应实质,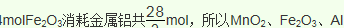
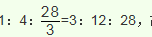
解析
解析已在路上飞奔,马上就到!
知识点
9. 下列物质可通过置换反应一步得到的是
①H2 ② FeCl3 ③ Fe3O4 ④ O2
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
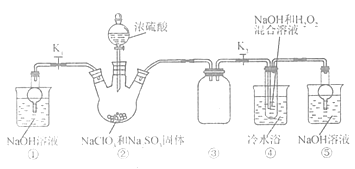
26. 某化学兴趣小组同学展开对漂白剂制亚氯酸钠(NaClO2)的研究。
实验I: 制取NaClO2 晶体
已知:NaClO2 饱和溶液在①温度低于38℃时析出晶体是NaClO2.H2O ②温度离于38℃时析出晶体是NaClO2 ③温度高于60℃时NaClO2分解成NaClO3和NaCl。
现利用如图所示装置进行实验。
(1)装置里③的作用是__________________________。
(2)装置中产生的ClO2化学方程式_______________________。装置④中制备NaClO2的化学方程式为_______________________。
(3)从装置反应后的溶液获得NaClO2晶体的操作步骤为①减压,55℃蒸发结晶,趁热过滤;③_______________________。④低手6℃干燥,得到成品。
实验II: 测定某亚氯酸钠样品的纯度
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加人适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应后,加蒸馏水至250 ml。(已知:
②移取25.00mL待测液于锥形瓶中,加几滴淀粉溶液,用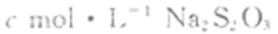
定,至滴定终点。重复2次,测得平均值为VmL(己知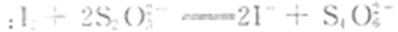
(4)达到滴定终点时的现象为_____________________________________。
(5)该样品中NaClO2(分子量=90.5)的质量分数为_______________________(用含m、c、V的代数式表示)。
(6)在滴定操作正确无误的情况下,此实验侧得结果偏高。原因用离子方程式表示为____
___________________。
正确答案
(1)安全瓶或防止倒吸
(2)
(3)用
(4)滴入最后一滴,溶液刚好由蓝色变为无色,且在半分钟内不变色。
(5)
(6)
解析
解析已在路上飞奔,马上就到!
知识点
12.在铁质品上镀上一定厚度的锌层,以下电镀方案正确的是( )
正确答案
解析
在Fe上镀上一定厚度的锌层,镀层作阳极、镀件作阴极,含有镀层金属阳离子的可溶性盐溶液为电解质溶液,所以Zn作阳极、Fe作阴极,含有锌离子可溶性盐为电解质
考查方向
电化学
解题思路
在Fe上镀上一定厚度的锌层,镀层作阳极、镀件作阴极,含有镀层金属阳离子的可溶性盐溶液为电解质溶液,据此分析解答
易错点
电镀池的基本构成条件
教师点评
本题考查电镀,为高频考点,把握阴阳极、电解质判断方法是解本题关键,电镀也属于电解,题目难度不大
知识点
1.下列有关金属及其化合物的说法正确的是
正确答案
解析
A.常见金属的冶炼方法有电解法、热还原法、热分解法等,其中Mg和Al都为活泼金属,应用电解法冶炼,故A正确;
B.铁和水蒸气在高温下反应生成四氧化三铁,不生成碱,故B错误;
C.Cu常温下与浓硝酸反应生成二氧化氮,Fe常温下在浓硝酸中钝化,故C错误;
D.Na2O和CO2反应生成碳酸钠,Na2O2与CO2反应除生成碳酸钠外,还有氧气,故D错误
考查方向
金属元素及其化合物的性质
解题思路
A.Mg和Al都为活泼金属,应用电解法冶炼;
B.铁和水蒸气在高温下反应生成四氧化三铁;
C.Cu常温下与浓硝酸反应,Fe常温下在浓硝酸中钝化;
D.Na2O和CO2反应生成碳酸钠,Na2O2与CO2反应生成碳酸钠和氧气
易错点
B项:铁和水蒸气在高温下反应不生成碱
教师点评
本题考查较为综合,涉及钠、镁、铝、铁等金属单质及其化合物的性质,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,难度不大
知识点
3.下列有关化学用语表示正确的是
正确答案
解析
A.二氧化碳的化学式为CO 2 ,碳和氧位于同一周期,从左到右原子半径逐渐减小,故碳的原子半径较大,故A错误;
B.硫离子核内含有16个质子,核外有3个电子层,最外层有8个电子,其结构示意图:
C. 原子符号中左上角的数字表示质量数,质量数=质子数+中子数,则中子数为20的氯原子表示为
D.HCN分子中存在C-H和C≡N,其结构式为H-C≡N,故正确;
考查方向
本题主要考查了核素;质量数与质子数、中子数之间的相互关系、化学用语的书写。
解题思路
A.二氧化碳的化学式为CO 2 ,碳和氧位于同一周期,从左到右原子半径逐渐减小,故碳的原子半径较大,故A错误;
B.硫离子核内含有16个质子,核外有3个电子层,最外层有8个电子,其结构示意图:
C. 原子符号中左上角的数字表示质量数,质量数=质子数+中子数,则中子数为20的氯原子表示为
D.HCN分子中存在C-H和C≡N,其结构式为H-C≡N,故正确;
易错点
1、化学用语的书写。
2、结构式的书写。
知识点
7.下列有关说法错误的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
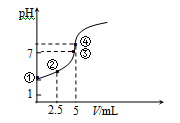
4.常温下向10 mL 0.1 mol·L-1 HN3(叠氮酸)溶液中逐滴滴加0.2 mol·L-1的NaOH溶液,
溶液pH的变化曲线如右下图所示(溶液混合时体积的变化、温度忽略不计,HN3的
Ka=10-4.7)。下列说法不正确的是( )
正确答案
解析
A、①点溶液显示酸性,叠氮酸量较多,所以水的电离受到抑制,③点溶液显示中性,水的电离不受影响,所以水电离出的c(OH-):①点小于③点,故A正确;
B、HN3(叠氮酸)溶液中逐滴滴加NaOH溶液,由于叠氮酸属于弱酸,所以不能用甲基橙做指示剂,应该使用酚酞,故B错误;
C、向10mL 0.1mol•L-1HN3(叠氮酸)溶液中逐滴滴加0.2mol•L-1的NaOH溶液2.5mL,此时得到的是叠氮酸和叠氮酸钠的混合液,溶液显示酸性,叠氮酸的电离程度大于叠氮酸根离子的水解程度,存在:c(N3-)>c(Na+)>c(HN3)>c(H+)>c(OH-),故C正确;
D、向10mL 0.1mol•L-1HN3(叠氮酸)溶液中逐滴滴加0.2mol•L-1的NaOH溶液5mL,此时二者恰好反应,得到叠氮酸钠溶液,溶液显示碱性存在物料守恒:c(Na+)=c(N3-)+c(HN3)=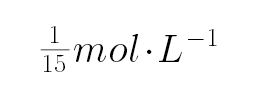
考查方向
本题考查了酸碱混合的定性判断、溶液pH计算、离子浓度大小比较
解题思路
A、根据图示信息,结合溶液的酸碱性判断水的电离程度;
B、HN3(叠氮酸)溶液中滴加NaOH溶液,根据叠氮酸属于弱酸来判断;
C、向10mL 0.1mol•L-1HN3(叠氮酸)溶液中逐滴滴加0.2mol•L-1的NaOH溶液2.5mL,此时得到的是叠氮酸和叠氮酸钠的混合液;
D、向10mL 0.1mol•L-1HN3(叠氮酸)溶液中逐滴滴加0.2mol•L-1的NaOH溶液5mL,此时二者恰好反应,得到叠氮酸钠溶液,根据物料守恒来计算.
易错点
图象曲线中各点的对应溶质组成
教师点评
本题考查了酸碱混合的定性判断、溶液pH计算、离子浓度大小比较,在近几年的各省高考题中出现的频率较高,常与盐类水解、弱电解质电离、pH计算等知识交汇命题
知识点
化学与生产、生活、社会密切相关。下列说法中不正确的是
正确答案
解析
略
知识点
下列说法正确的是
正确答案
解析
略。
知识点
2.在火星上工作的美国“勇气号”、“机遇号”探测车的一个重要任务就是收集有关Fe2O3及其硫酸盐的信息,用以证明火星上存在或曾经存在过水,以下叙述正确的是
正确答案
解析
A.Fe2O3与Fe3O4不互为同素异形体,它们不是单质,故A错误
B. 步骤为:样品→粉碎→加稀盐酸溶解→过滤 →向滤液中滴加KSCN溶液,故B错误
C. 将CO2通入BaCl2溶液中至饱和,最终会生成碳酸氢钡,无沉淀生成,故C错误
D. 铝的制备电解氧化铝,而Fe、Cu用还原剂还原,故D正确
故题选择D
考查方向
解题思路
A.Fe2O3与Fe3O4不互为同素异形体,它们不是单质。
B. 步骤为:样品→粉碎→加稀盐酸溶解→过滤 →向滤液中滴加KSCN溶液
C. 将CO2通入BaCl2溶液中至饱和,最终会生成碳酸氢钡,无沉淀生成
D. 铝的制备电解氧化铝,而Fe、Cu用还原剂还原
易错点
将CO2通入BaCl2溶液中至饱和,只考虑到有碳酸钡生成
知识点
扫码查看完整答案与解析