- 常见无机物及其应用
- 共1311题
3.能正确表示下列反应的离子方程式是( )
正确答案
解析
A.向硫酸铜溶液中加入过量NaHS溶液,反应生成CuS、硫化氢和硫酸钠,离子方程式:Cu2++2HS-=CuS↓+H2S↑,故A正确;
B.NH4Al(SO4)2溶液与足量Ba(OH)2溶液混合,二者反应生成硫酸钡沉淀、偏铝酸钡、一水合氨,离子方程式为:2NH4++2Al3++4SO42-+4Ba2++10OH-═4BaSO4↓+2AlO2-+2NH3•H2O+2H2O,故B错误;
C.亚硫酸根离子具有还原性,能被氯气氧化生成硫酸根离子,所以硫代硫酸根离子和氯气发生氧化还原反应生成氯离子、硫酸根离子和氢离子,离子方程式为: S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+,故C错误;
D.铅蓄电池充电时,原来的负极变为阴极,阴极发生还原反应,应该是得电子的反应,故D错误;
考查方向
本题主要考查离子方程式的正误判断。
解题思路
A项正确;B项足量的Ba(OH)2溶液不能生成Al(OH)3↓;C项足量氯气应将S2O32-氧化成SO42-;D项PbSO4+2H2O-2e-= PbO2+4H++SO42—是铅酸蓄电池充电时的正极反应。
易错点
不能从电荷守恒、质量守恒、那些物质该拆和不该拆、是否违背客观事实等角度去判断。
知识点
化学反应原理在科研和生产中有广泛应用.
12.Ⅰ.氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用下图表示。
(1)海洋中的氮循环起始于氮的固定,其中属于固氮作用的一步是 (填图中数字序号)。
(2)有氧时,在硝化细菌作用下,NH4+可实现过程④的转化,将过程④的离子方程式补充完整:________NH4+ + 5O2 == 2NO2- + ________H+ +__________+__________
13.Ⅱ.工业合成氨原理是:N2(g)+3H2(g)
(1)曲线a对应的温度是 。
(2)关于工业合成氨的反应,下列叙述正确的是 。
A.及时分离出NH3可以提高H2的平衡转化率
B.上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N)
C.M点比N点的反应速率快
D.由曲线a可知,当压强增加到100 MPa以上,NH3的物质的量分数可达到100%
(3)如果N点时c(NH3)=0.2mol·L-1,N点的化学平衡常数K= L2/mol2 (精确到小数点后两位)
14.Ⅲ.尿素[CO(NH2)2]是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为两步反应:
第一步:2NH3(g)+CO2(g) 
第二步:H2NCOONH4(s) 
(1)写出工业上以NH3、CO2为原料合成尿素的热化学方程式:_________________________
(2)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L的密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如下图所示:
①反应进行到10 min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)= mol/(L·min)。
②已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_________步反应决定,总反应进行到_________min时到达平衡。
正确答案
(1)②
(2) 4NH4+ + 5O2 = 2NO2- + 6H+ + N2O + 5H2O
解析
将空气中的游离氮转化为化合态氮的过程,称为固氮(nitrogen fixation) ,分为人工固氮和天然固氮 两种。人工固氮是指工业上通常用H2和N2 在催化剂、高温、高压下合成氨;、天然固氮是指闪电能使空气里的氮气转化为一氧化氮,一次闪电能生成80~1500kg的一氧化氮。这也是一种自然固氮。自然固氮远远满足不了农业生产的需求。
考查方向
解题思路
根据题目相关信息判断反应发生情况。
易错点
氮的固定
正确答案
(1)200℃
(2)AB
(3)0.93
解析
(1)正反应放热,降低温度,反应往正反应方向进行,故而氨气的质量分数越来越大。
(2)A、分离出氨气,反应物浓度减小,反应往正方向进行,氢气的平衡转化率增大;
B、Q、M在同一条平衡曲线上,平衡常数大小相等,M、N压强相同,从N到是降低温度,反应往正反应方向进行,平衡常数增大;
C、反应速率还和时间有关;
D、可逆反应达不到100%。
考查方向
解题思路
根据题目相关信息判断反应发生情况。
易错点
化学平衡移动
正确答案
(1)2NH3(g)+CO2(g)
(2)①0.148 ② 二 55
解析
(1)第一步+第二步得:2NH3(g)+CO2(g)
(2)①v=n/(v.t)=(1mol-0.26mol)÷0.5L÷10min=0.148mol/(L·min)②第二步反应越慢生成的尿素越多;读图知反应到55分钟时达到平衡。
考查方向
解题思路
根据题目相关信息判断反应发生情况。
易错点
化学平衡移动
NaCN为剧毒无机物。某兴趣小组查资料得知,实验室里的NaCN溶液可使用Na2S2O3溶液进行解毒销毁,他们开展了以下三个实验,请根据要求回答问题:
实验Ⅰ.硫代硫酸钠晶体(Na2S2O3·5H2O)的制备:
已知Na2S2O3·5H2O对热不稳定,超过48℃即开始丢失结晶水。现以Na2CO3和Na2S物质的量之比为2∶1的混合溶液及SO2气体为原料,采用如图装置制备Na2S2O3·5H2O。
Ⅱ.产品纯度的检测:
Ⅲ.有毒废水的处理:
17.将Na2S和Na2CO3按反应要求的比例一并放入三颈烧瓶中,注入150 mL蒸馏水使其溶解,在蒸馏烧瓶中加入Na2SO3固体,在分液漏斗中注入____________(填以下选择项的字母),并按下图安装好装置,进行反应。
18.pH小于7会引起Na2S2O3溶液的变质反应,会出现淡黄色混浊。反应约半小时,当溶液pH接近或不小于7时,即可停止通气和加热。如果通入SO2过量,发生的化学反应方程式为_________________;
19.从上述生成物混合液中获得较高产率Na2S2O3·5H2O的歩骤为
为减少产品的损失,操作①为趁热过滤,其目的是______________________________;
操作②是___________________________________;操作③是抽滤、洗涤、干燥。
20.已知:Na2S2O3·5H2O的摩尔质量为248 g/mol;2Na2S2O3+I2=2NaI+Na2S4O6。取晶体样品a g,加水溶解后,滴入几滴淀粉溶液,用0.010 mol/L碘水滴定到终点时,消耗碘水溶液v mL,则该样品纯度是______________________;
21.滴定过程中可能造成实验结果偏低的是___________________;
22.兴趣小组的同学在采取系列防护措施及老师的指导下进行以下实验:
向装有2 mL 0.1 mol/L 的NaCN溶液的试管中滴加2 mL 0.1mol/L 的Na2S2O3溶液,两反应物恰好完全反应,但无明显现象,取反应后的溶液少许滴入盛有10 mL 0.1 mol/L FeCl3溶液的小烧杯,溶液呈现血红色,请写出Na2S2O3解毒的离子反应方程式____________________
正确答案
解析
(1)制取SO2时,为减少SO2在水的溶解,且使反应速度较快常用70%的硫酸。
考查方向
解题思路
认真审题把握相关信息,在解题过程中适时运用。如操作②是什么就要根据已知信息Na2S2O3·5H2O对热不稳定,超过48℃即开始丢失结晶水采用降温结晶的方法,而不能采用蒸发结晶的方法。
易错点
滴定过程中依据化学方程式进行计算与误差分
正确答案
(2)Na2S2O3 +SO2+H2O=2NaHSO3+S↓
解析
(2)由信息提示可知如通入过量的二氧化硫将会与Na2S2O3发生氧化还原反应得到S单质,反应方程为:Na2S2O3 +SO2+H2O=2NaHSO3+S↓。
考查方向
解题思路
认真审题把握相关信息,在解题过程中适时运用。如操作②是什么就要根据已知信息Na2S2O3·5H2O对热不稳定,超过48℃即开始丢失结晶水采用降温结晶的方法,而不能采用蒸发结晶的方法。
易错点
滴定过程中依据化学方程式进行计算与误差分
正确答案
(3)趁热是为了防止晶体在过滤的过程中在漏斗中析出导致产率降低;过滤是为了除去活性炭、硫等不溶性杂质蒸发浓缩,冷却结晶;
解析
(3)过滤是为了除去活性炭、硫等不溶性杂质。趁热是为了防止晶体在过滤的过程中在漏斗中析出导致产率降低;从流程中可以看到滤液经②③2步后,得到了晶体,所以步骤②是将晶体从溶液中结晶出来,考虑到Na2S2O3·5H2O对热不稳定,超过48℃即开始丢失结晶水,所以应当采用降温结晶的方法。
考查方向
解题思路
认真审题把握相关信息,在解题过程中适时运用。如操作②是什么就要根据已知信息Na2S2O3·5H2O对热不稳定,超过48℃即开始丢失结晶水采用降温结晶的方法,而不能采用蒸发结晶的方法。
易错点
滴定过程中依据化学方程式进行计算与误差分
正确答案
(4) ×100%
解析
(4)利用关系式: 2Na2S2O3——I2 n(I2)=,则n(Na2S2O3)=,再算出其质量后便可求出其纯度为。
考查方向
解题思路
认真审题把握相关信息,在解题过程中适时运用。如操作②是什么就要根据已知信息Na2S2O3·5H2O对热不稳定,超过48℃即开始丢失结晶水采用降温结晶的方法,而不能采用蒸发结晶的方法。
易错点
滴定过程中依据化学方程式进行计算与误差分
正确答案
解析
(5)锥形瓶本身就不能用Na2S2O3溶液润洗,润洗了会使结果偏高,A错误。锥形瓶中溶液变蓝后需等30s,溶液不褪色才能判断滴定终点,如果立刻停止滴定进行读数,会使所滴加的碘水体积偏小,造成结果偏低,B错误。滴定终点时仰视读数,使体积偏大,结果偏大,C错误。滴定管尖嘴内滴定前无气泡,滴定终点发现气泡,使滴定过程中碘水的体积读数偏小,结果偏低,D正确。
考查方向
解题思路
认真审题把握相关信息,在解题过程中适时运用。如操作②是什么就要根据已知信息Na2S2O3·5H2O对热不稳定,超过48℃即开始丢失结晶水采用降温结晶的方法,而不能采用蒸发结晶的方法。
易错点
滴定过程中依据化学方程式进行计算与误差分
正确答案
CN-+S2O32-= SCN-+SO32-
解析
(6)从信息加入FeCl3溶液变红分析得出,产物中一定会有SCN-,结合化合价变化利用得失电子守恒得出反应为:CN-+S2O32-= SCN-+SO32-。
考查方向
解题思路
认真审题把握相关信息,在解题过程中适时运用。如操作②是什么就要根据已知信息Na2S2O3·5H2O对热不稳定,超过48℃即开始丢失结晶水采用降温结晶的方法,而不能采用蒸发结晶的方法。
易错点
滴定过程中依据化学方程式进行计算与误差分
6.足量铜溶于一定量浓硝酸,产生NO2、N2O4、NO的混合气体,这些气体若与2.24LO2(标准状况)混合后通入水中,气体被水完全吸收.若向原所得溶液中加入l0mol•L﹣1H2SO4溶液100mL,则继续溶解的Cu的质量为( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
4.下列措施不合理的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
2.能证明BF3为平面三角形而不是三角锥形分子的理由是( )
正确答案
解析
A.BF2Cl只有一种结构,可能为三角锥型,不一定为平面三角形,故A错误;
B.BF3中B的价电子结构为2s22p1,价电子对数为: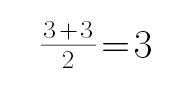
C.BFCl2只有一种结构,可能为三角锥型,不一定为平面三角形,故C错误;
D.三根B-F键键长都为130pm,可能为三角锥型中棱相等,不能说明BF3为平面三角形,故D错误;
考查方向
原子组成与结构
解题思路
根据价电子对数判断其杂化类型,根据形成的杂化轨道判断其空间构型,BF3中B的价电子结构为2s22p1,形成了三条杂化轨道,B的杂化类型为sp2,三个sp2杂化轨道分别与三个F原子的p轨道成键,三根B-F键间键角都为120°,为平面三角形,BFCl2、BF2Cl只有一种结构,三根B-F键键长相等,也可能为三角锥型
易错点
键长相等,也可能为三角锥型
教师点评
本题主要以BF3的分子构型考查了杂化轨道理论的应用,题目难度不大
知识点
5.KAl(SO4)2.KFe(SO4)2 .(NH4)Fe(SO4)2都属于复盐,通过类比判断,下列属于复盐的是
正确答案
解析
“复盐”是指含有多种简单阳离子和一种酸根阴离子的盐,A答案中阳离子只有Na+,c中阳离子只有Ca2+,D中阳离子只有Na+,故ACD不属于复盐
考查方向
物质的分类
解题思路
盐是由金属阳离子(铵根离子)和酸根阴离子组成的化合物,“复盐”是指含有多种简单阳离子和一种酸根阴离子的盐
易错点
由题干信息得出复盐的构成
教师点评
本题是信息给予题,注意根据盐的概念和题目中信息分析解答,考查学生提练加工信息的能力
知识点
Dogs are often【C1】______man’s best friend. For those who are blind, a dog is【C2】______than a friendly company. A dog is a pair of sharp eyes. A【C3】______dog guide gives blind people the【C4】______to move through the world safely and freely. A dog guide is also a best friend. 【C5】______a working team of a dog and a person is not easy. There are no factories making thousands of dog guides a day. There are however, schools all【C6】______the country that train both blind people and the dogs they depend upon. The process of education is long for both the dog and its human partner. A dog begins schooling as puppy. Around age of 8 weeks, the puppy is placed with a faster family. There it【C7】______training and gets used to【C8】______around people. When a dog is about a year old, it goes off to school for a series of tests. These tests help the school【C9】______whether the dog is likely to make a good guide. Dogs that fail the tests are placed in permanent homes. 【C10】______that pass the tests go into a training【C11】______ For the next four-to-six months, the dog learns everything【C12】______needs to become a dog 【C13】______The dog learns to stay focused. It learns to ignore food, smell and other animals. It learns to remain【C14】______by such noises such【C15】______shouting or music from a passing car radio. It learns to【C16】______commands like "right", " left" or " forward ". The dog learns to stop before every curb and stairway and to【C17】______moving objects. In short, good dog guides learn to keep their【C18】______safe while they go about the everyday actions of life. A dog that【C19】______completed training will be【C20】______a master.【C11】
A.test
B.practice
C.play
D.programme
正确答案
D
解析
暂无解析
高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性。
21.已知:4FeO42-+10H2O 
22.高铁酸钾有以下几种常见制备方法:
①干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为______________。
②湿法制备中,若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式:____________________。
③制备中间产物Na2FeO4,可采用的装置如图所示,则阳极的电极反应
式为 。
23.比亚迪双模电动汽车使用高铁电池供电,其总反应为: 3Zn+2K2FeO4+8H2O 
24.25℃时,CaFeO4的Ksp=4.54×l0-9,若要使1000 L含有2.0×l0-4 mol·L-l K2FeO4的废水中的c(FeO42-)有沉淀产生,理论上至少加入Ca(OH)2的物质的量为____ mol。
正确答案
K2FeO4具有强氧化性,能够消毒杀菌;同时FeO42- 被还原成Fe3+,Fe3+水解形成Fe(OH)3胶体,能够吸附水中悬浮杂质 11.50
解析
在K2FeO4中Fe的化合价为+6价,具有强氧化性,能够对水进行杀菌消毒;同时FeO42- 被还原成Fe3+,Fe3+水解形成Fe(OH)3胶体,表面积大吸附力强,能够吸附水中悬浮杂质,从而可以起到净化作用;根据方程式4FeO42-+10H2O
考查方向
解题思路
在K2FeO4中Fe的化合价为+6价,具有强氧化性,FeO42- 被还原成Fe3+,Fe3+水解形成Fe(OH)3胶体
易错点
Ksp的计算、电极方程式的书写。
正确答案
①3:1;
② 2FeO42-+Fe3++8OH-=3FeO43-+4H2O
③Fe+8OH--6e─=FeO42─+4H2O
解析
①干法制备K2FeO4的反应是Fe2O3+3KNO3+4KOH
②湿法制备中,若Fe(NO3) 3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式:2FeO42-+Fe3++8OH-=3FeO43-+4H2O;
③制备中间产物Na2FeO4,若采用电解的方法,则阳极Fe的电极反应式为Fe+8OH--6e─=FeO42─+4H2O;
考查方向
解题思路
①干法制备K2FeO4的反应中氧化剂KNO3与还原剂Fe2O3的物质的量之比为3:1;
②湿法制备中,若Fe(NO3) 3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4
易错点
Ksp的计算、电极方程式的书写。
正确答案
变小 FeO42-+4H2O+3e-== Fe(OH)3+5OH-;(4)2.27×10-2。
解析
比亚迪双模电动汽车使用高铁电池供电,其总反应为:3Zn+2K2FeO4+8H2O 
考查方向
解题思路
在放电时负极材料为失去电子变为Zn2+结合氢氧根,故PH变小。
易错点
Ksp的计算、电极方程式的书写。
正确答案
2.27×10-2
解析
比亚迪双模电动汽车使用高铁电池供电,其总反应为:3Zn+2K2FeO4+8H2O 
考查方向
本题主要考查了电化学、Ksp的计算。
解题思路
在放电时负极材料为失去电子变为Zn2+结合氢氧根,故PH变小。
易错点
Ksp的计算、电极方程式的书写。
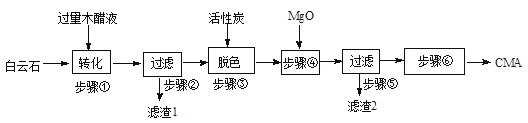
CMA(醋酸钙、醋酸镁固体的混合物)是高速公路的绿色融雪剂。以生物质废液——木醋液(主要成分乙酸,以及少量的甲醇、苯酚、焦油等杂质)及白云石(主要成分MgCO3·CaCO3,含SiO2等杂质)等为原料生产CMA的实验流程如下:
8.步骤①发生的反应离子方程式为 。
9.步骤②所得滤渣1的主要成分为____________(写化学式);步骤②所得滤液常呈褐色,颜色除与木醋液中含有少量的有色的焦油有关外,产生颜色的另一主要原因是____________。
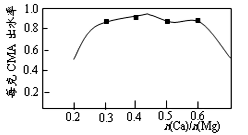
10.已知CMA中钙、镁的物质的量之比与出水率(与融雪效果成正比)关系如右图所示,步骤④的目的除调节n(Ca)∶n(Mg)约为____________(选填:1∶2;3∶7;2∶3)外,另一目的是 。
11.步骤⑥包含的操作有____________、过滤、洗涤及干燥。
12.碳酸镁和碳酸钙与醋酸也可以恰好完全反应得到的混合物制融雪剂,下列有关说法错误的是( )
正确答案
MgCO3·CaCO3+4CH3COOH= Ca2++Mg2++4CH3COO-+2CO2↑+2H2O;
正确答案
SiO2;实验过程中苯酚被空气中氧气氧化最终产生褐色物质;
正确答案
3∶7;除去过量的乙酸;
正确答案
蒸发结晶
正确答案
下列各组物质混合后,加热、蒸干、灼烧至质量不变,最终能得到纯净物的是
正确答案
解析
略
知识点
下列物质与水作用形成的溶液能与

正确答案
解析
考Na与水反应生成氢氧化钠后,再与
知识点
下列实验的现象与对应结论均正确的是( )
正确答案
解析
浓硫酸的脱水性和强氧化性,能与蔗糖固体变黑,A项正确;Al在常温下与浓硝酸反应发生钝化,钝化也是化学反应,B项错误;Na与无水乙醇反应得到H2,反应原理是Na置换出醇羟基中的氢,C项正确;水蒸气通过灼热的铁粉,得到的是黑色的Fe3O4,D项错误。
知识点
下列金属中,表面自然形成的氧化层能保护内层金属不被空气氧化的是
正确答案
解析
略
知识点
7.下列说法不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析