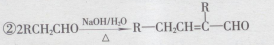- 金属腐蚀的化学原理
- 共23题
化学反应原理在科研和生产中有广泛应用.
12.Ⅰ.氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用下图表示。
(1)海洋中的氮循环起始于氮的固定,其中属于固氮作用的一步是 (填图中数字序号)。
(2)有氧时,在硝化细菌作用下,NH4+可实现过程④的转化,将过程④的离子方程式补充完整:________NH4+ + 5O2 == 2NO2- + ________H+ +__________+__________
13.Ⅱ.工业合成氨原理是:N2(g)+3H2(g)
(1)曲线a对应的温度是 。
(2)关于工业合成氨的反应,下列叙述正确的是 。
A.及时分离出NH3可以提高H2的平衡转化率
B.上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N)
C.M点比N点的反应速率快
D.由曲线a可知,当压强增加到100 MPa以上,NH3的物质的量分数可达到100%
(3)如果N点时c(NH3)=0.2mol·L-1,N点的化学平衡常数K= L2/mol2 (精确到小数点后两位)
14.Ⅲ.尿素[CO(NH2)2]是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为两步反应:
第一步:2NH3(g)+CO2(g) 
第二步:H2NCOONH4(s) 
(1)写出工业上以NH3、CO2为原料合成尿素的热化学方程式:_________________________
(2)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L的密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如下图所示:
①反应进行到10 min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)= mol/(L·min)。
②已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_________步反应决定,总反应进行到_________min时到达平衡。
正确答案
(1)②
(2) 4NH4+ + 5O2 = 2NO2- + 6H+ + N2O + 5H2O
解析
将空气中的游离氮转化为化合态氮的过程,称为固氮(nitrogen fixation) ,分为人工固氮和天然固氮 两种。人工固氮是指工业上通常用H2和N2 在催化剂、高温、高压下合成氨;、天然固氮是指闪电能使空气里的氮气转化为一氧化氮,一次闪电能生成80~1500kg的一氧化氮。这也是一种自然固氮。自然固氮远远满足不了农业生产的需求。
考查方向
解题思路
根据题目相关信息判断反应发生情况。
易错点
氮的固定
正确答案
(1)200℃
(2)AB
(3)0.93
解析
(1)正反应放热,降低温度,反应往正反应方向进行,故而氨气的质量分数越来越大。
(2)A、分离出氨气,反应物浓度减小,反应往正方向进行,氢气的平衡转化率增大;
B、Q、M在同一条平衡曲线上,平衡常数大小相等,M、N压强相同,从N到是降低温度,反应往正反应方向进行,平衡常数增大;
C、反应速率还和时间有关;
D、可逆反应达不到100%。
考查方向
解题思路
根据题目相关信息判断反应发生情况。
易错点
化学平衡移动
正确答案
(1)2NH3(g)+CO2(g)
(2)①0.148 ② 二 55
解析
(1)第一步+第二步得:2NH3(g)+CO2(g)
(2)①v=n/(v.t)=(1mol-0.26mol)÷0.5L÷10min=0.148mol/(L·min)②第二步反应越慢生成的尿素越多;读图知反应到55分钟时达到平衡。
考查方向
解题思路
根据题目相关信息判断反应发生情况。
易错点
化学平衡移动
5.下列结论正确的是( )
①微粒半径:S
②氢化物稳定性:HF>HCl>H2S>H2Se
③离子还原性:S


④单质氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4>H2SeO4
⑥分散系中分散质粒子的直径:Fe (OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.乳酸的结构简式为
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
9.下列反应中,反应后固体物质增重的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
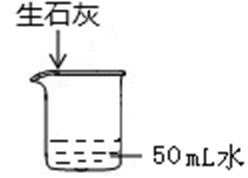
19.常温下向盛水烧杯中加2g生石灰(如下图)。搅拌后再恢复到原温,在此过程中,下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
选考题:请考生从给出的3道化学题中任选一题作答。
36.【化学选修2-化学与技术】
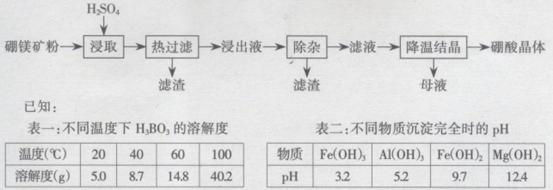
以硼镁矿( 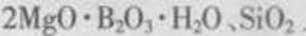
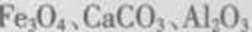
(1)由于矿粉中含CaCO3 ,“浸取”时容易产生大量泡沫使物料从反应器中溢出,应采取的措施为________________________________________。
(2)“浸出液”显酸性,含有H3BO3、Mg2+和SO42-,还含有Fe2+、Fe3+、Ca2+、Al3+等杂质。“除杂”时,向浸出液中依次加入适量目H2O2和MgO,可以除去的杂质离子为_________,的作用为_________(用离子方程式表示)。
(3)“浸取”后,采用“热过滤”的目的为_______。
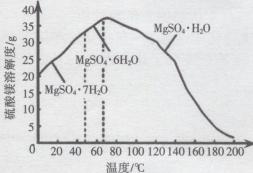
(4)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如图所示,且溶液的沸点随压强增大而升高。为了从“母液”中充分回收 MgSO4.H2O,应采取的措施是将“母液”蒸发浓缩,____。
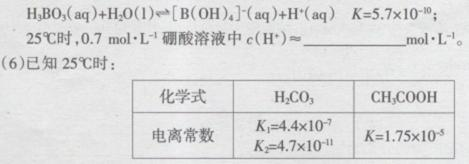
(5)已知25℃时,硼酸( H3BO3)溶液中存在如下平衡:
下列说法正确的是_____________(填选项字母)。
A.碳酸钠溶液滴入硼酸溶液中能观察到有气泡产生
B.碳酸钠溶液滴入醋酸溶液中能观察到有气泡产生
C.等浓度碳酸溶液和硼酸溶液的pH:前者>后者
D.等浓度碳酸钠溶液和醋酸钠溶液的pH:前者>后者
37.【化学选修3-物质结构与性质】
a、b、c、d、e均为周期表前四周期元素,原子序数依次增大,相关信息如下表所示。
请回答:
(1)d属于________区的元素,其基态原子的价电子排布图为_________。
(2)b与其同周期相邻元素第一电离能由大到小的顺序为________(用元素符号表示)。
(3)c的氢化物水溶液中存在的氢键有________种,任意画出一种_________。
(4)a与其相邻同主族元素的最高价氧化物的熔点高低顺序为________(用化学式表示)。若将a元素最高价氧化物水化物对应的正盐酸根离子表示为A,则A的空间构型为________;A的中心原子的轨道杂化类型为________;与A互为等电子体的一种分子为________(填化学式)。
(5)e与Au的合金可形成面心立方最密堆积的晶体,在晶胞中e原子处于面心,该晶体 具有储氢功能,氢原子可进入到由e原子与Au原子构成的四面体空隙中,储氢后的 晶胞结构与金刚石晶胞结构相似,该晶体储氢后的化学式为________,若该晶体的相对分子质量为M,密度为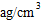
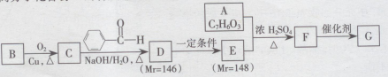
38.【化学选修5-有机化学基础】
有机高分子化合物G的合成路线如下:
已知:
①A既能与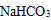
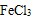
请回答:
(1)B的名称为________,G中含有的官能团名称为________。
(2)B→C、D→E的反应类型分别为________、________。
(3)A+E→F的化学方程式为________。
(4)D发生银镜反应的化学方程式为________。
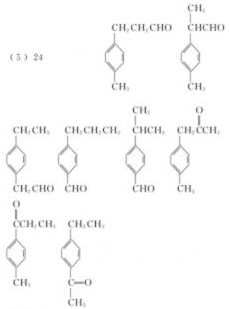
(5)符合下列条件的E的同分异构体有________种(不考虑立体异构),写出其中一种的结
构简式________。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
7.化学
正确答案
知识点
9.能正确表示下列反应离子方程式的是:
正确答案
解析
A. 电荷不守恒。
B. 碳酸氢根不可以再拆。
D. 漂白液的有效成分是NaClO。
考查方向
解题思路
根据离子方式的书写规则,先写出正确的化学方程式,在溶液中可以完全电离的写成离子的形式,把没有参加反应的离子如数抵消,最后检查电荷数是否守恒元素是否守恒。
易错点
1、元素守恒,电荷守恒的应用;
2、哪些物质可以拆成离子的形式会忘记。
知识点
高锰酸钾可用于生活消毒,是中学化学常见的氧化剂。工业上,用软锰矿制高锰酸钾的流程如下:
请回答下列问题:
14.该生产中需要纯净的CO2气体.写出实验室制取CO2的化学方程式 。
15.KMnO4稀溶液是一种常用的消毒剂.其消毒原理与下列物质相同的是 (填字母).
16.写出二氧化锰和氢氧化钾熔融物中通入空气时发生的主要化学反应的方程式: 。
17.上述流程中可以循环使用的物质有 、 (写化学式).
18.测定高锰酸钾样品纯度采用硫酸锰滴定:向高锰酸钾溶液中滴加硫酸锰溶液,产生黑色沉淀。当溶液由紫红色刚好褪色且半分钟不恢复,表明达到滴定终点。写出该反应的离子方程式: 。
19.已知:常温下,Ksp[Mn(OH)2]=2.4×10-13。工业上,调节pH可以沉淀废水中Mn2+,当pH=10时,溶液中c(Mn2)= ___________________。
20.操作Ⅰ的名称是 ;操作Ⅱ根据KMnO4和K2CO3两物质在溶解性上的差异,采用 (填操作步骤)、趁热过滤得到KMnO4粗晶体.
正确答案
CaCO3+2HCl = CaCl2 + CO2 ↑+H2O
解析
实验室制CO2相对简单,请识记。
考查方向
本题考查化学实验基本操作实验分析及化学计算,考查学生实验基本能力实验分析及计算能力,实验室各种气体的制备、漂白原理、滴定操作、溶度积常熟的应用,离子方程式书写。
解题思路
通入空气生成了K2MnO4,其中的锰元素的化合价升高,所以在熔融的过程中肯定发生了氧化还原反应,空气中的氧气作氧化剂。
易错点
漂白与消毒原理。
正确答案
解析
KMnO4的消毒原理是利用其强氧化性,酒精是指蛋白质变性杀菌消毒,苯酚有毒,双氧水、 84消毒液(NaClO溶液)利用其强氧化性消毒。
考查方向
解题思路
二氧化碳的制备利用强酸制弱酸原理。
易错点
滴定法测定原理。
正确答案
2MnO2+4KOH+O2=2K2MnO4+2H2O
解析
因为锰元素的化合价升高所以空气中的O2作氧化剂,然后根据得失电子守恒配平就不难。
考查方向
解题思路
操作Ⅰ中只有MnO2不溶于水,所以分离方法是过滤,操作Ⅱ将两个可溶性的钾盐分离,只能利用其溶解度随温度的变化而不同,故结晶法。
易错点
溶度积常数的理解及应用。
正确答案
KOH、MnO2
解析
从流程图不难看出KOH、MnO2是循环使用的。
考查方向
本题考查化学实验基本操作实验分析及化学计算,考查学生实验基本能力实验分析及计算能力,实验室各种气体的制备、漂白原理、滴定操作、溶度积常熟的应用,离子方程式书写。
解题思路
可以重复利用的物质主要看图,前后都出现的物质就是。
易错点
离子方程式的书写。
正确答案
2MnO4-+3Mn2++2H2O=5MnO2↓+4H+
解析
这时候锰元素的归中反应,配平离子方程式的时用电荷守恒。
考查方向
本题考查化学实验基本操作实验分析及化学计算,考查学生实验基本能力实验分析及计算能力,实验室各种气体的制备、漂白原理、滴定操作、溶度积常熟的应用,离子方程式书写。
解题思路
滴定法利用的是两种物质关系进行计算。
易错点
滴定终点的判定
正确答案
2.0×10-15mol/L
解析
Ksp[Mn(OH)2]= c(Mn2+)×c2(OH-),当pH=10时,c (OH-)=10-4。
考查方向
本题考查化学实验基本操作实验分析及化学计算,考查学生实验基本能力实验分析及计算能力,实验室各种气体的制备、漂白原理、滴定操作、溶度积常熟的应用,离子方程式书写。
解题思路
溶度积常数满足饱和溶液。
易错点
结晶与重结晶的实验操作。
正确答案
过滤,溶解后蒸发浓缩
解析
重结晶的物理方法主要就考虑溶解度随温度的变化不同。
考查方向
本题考查化学实验基本操作实验分析及化学计算,考查学生实验基本能力实验分析及计算能力,实验室各种气体的制备、漂白原理、滴定操作、溶度积常熟的应用,离子方程式书写。
解题思路
对于不可用化学方法分离的物质要考虑结晶等物理方法。
易错点
工艺流程图的解读。
高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性。
21.已知:4FeO42-+10H2O 
22.高铁酸钾有以下几种常见制备方法:
①干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为______________。
②湿法制备中,若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式:____________________。
③制备中间产物Na2FeO4,可采用的装置如图所示,则阳极的电极反应
式为 。
23.比亚迪双模电动汽车使用高铁电池供电,其总反应为: 3Zn+2K2FeO4+8H2O 
24.25℃时,CaFeO4的Ksp=4.54×l0-9,若要使1000 L含有2.0×l0-4 mol·L-l K2FeO4的废水中的c(FeO42-)有沉淀产生,理论上至少加入Ca(OH)2的物质的量为____ mol。
正确答案
K2FeO4具有强氧化性,能够消毒杀菌;同时FeO42- 被还原成Fe3+,Fe3+水解形成Fe(OH)3胶体,能够吸附水中悬浮杂质 11.50
解析
在K2FeO4中Fe的化合价为+6价,具有强氧化性,能够对水进行杀菌消毒;同时FeO42- 被还原成Fe3+,Fe3+水解形成Fe(OH)3胶体,表面积大吸附力强,能够吸附水中悬浮杂质,从而可以起到净化作用;根据方程式4FeO42-+10H2O
考查方向
解题思路
在K2FeO4中Fe的化合价为+6价,具有强氧化性,FeO42- 被还原成Fe3+,Fe3+水解形成Fe(OH)3胶体
易错点
Ksp的计算、电极方程式的书写。
正确答案
①3:1;
② 2FeO42-+Fe3++8OH-=3FeO43-+4H2O
③Fe+8OH--6e─=FeO42─+4H2O
解析
①干法制备K2FeO4的反应是Fe2O3+3KNO3+4KOH
②湿法制备中,若Fe(NO3) 3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式:2FeO42-+Fe3++8OH-=3FeO43-+4H2O;
③制备中间产物Na2FeO4,若采用电解的方法,则阳极Fe的电极反应式为Fe+8OH--6e─=FeO42─+4H2O;
考查方向
解题思路
①干法制备K2FeO4的反应中氧化剂KNO3与还原剂Fe2O3的物质的量之比为3:1;
②湿法制备中,若Fe(NO3) 3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4
易错点
Ksp的计算、电极方程式的书写。
正确答案
变小 FeO42-+4H2O+3e-== Fe(OH)3+5OH-;(4)2.27×10-2。
解析
比亚迪双模电动汽车使用高铁电池供电,其总反应为:3Zn+2K2FeO4+8H2O 
考查方向
解题思路
在放电时负极材料为失去电子变为Zn2+结合氢氧根,故PH变小。
易错点
Ksp的计算、电极方程式的书写。
正确答案
2.27×10-2
解析
比亚迪双模电动汽车使用高铁电池供电,其总反应为:3Zn+2K2FeO4+8H2O 
考查方向
本题主要考查了电化学、Ksp的计算。
解题思路
在放电时负极材料为失去电子变为Zn2+结合氢氧根,故PH变小。
易错点
Ksp的计算、电极方程式的书写。
扫码查看完整答案与解析