- 化学实验方案的设计与评价
- 共98题
13.根据下列实验操作和现象所得到的结论正确的是
正确答案
解析
A、室温下,向苯酚钠溶液中通入足量CO2,发生反应:


考查方向
解题思路
有关实验方案的设计和对实验方案的评价是高考的热点之一,设计实验方案时,要注意用最少的药品和最简单的方法;关于对实验设计方案的评价,要在两个方面考虑,一是方案是否可行,能否达到实验目的;二是设计的方法进行比较,那种方法更简便。化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,并有助于提高观察、实验能力,所以,对化学实验不仅要认真观察,还应掌握观察实验现象的方法。
易错点
B项中Ksp大小的比较通过沉淀的转化或数据才能比较。
知识点
hibernation
正确答案
heavily
正确答案
25.为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验。可选用的试剂:KSCN溶液、KMnO4溶液、氯水。
(1)请完成下表:
【实验结论】Fe的氧化产物为Fe2+和Fe3+
Ⅱ.AgNO3的热稳定性
用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束后,试管中残留固体为黑色。
(2)装置B的作用是___________。
(3)经小组讨论并验证该无色气体为O2,其
(4)【查阅资料】Ag2O和粉末状的A

【提出设想】试管中残留的黑色固体可能是:ⅰ.Ag;ⅱ.Ag2O;ⅲ.Ag和Ag2O。
【实验验证】该小组为验证上述设想,分别取少量黑色固体放入试管中,进行了如下实验。
【实验评价】根据上述实验,不能确定固体产物成分的实验是___________(填实验编号)。
【实验结论】根据上述实验结果,该小组得出AgNO3固体热分解的产物有___________。
正确答案
(1)
①溶液呈红色
②K2[Fe(CN)6]溶液
③产生蓝色沉淀
(2)防倒吸
(3)用带火星的木条伸入集气瓶内,木条复燃,证明无色气体为O2
(4)① b ②Ag、NO2、O2
解析
解析已在路上飞奔,马上就到!
知识点
27. 实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件。该小组同学为探究中毒原因进行了如下实验。
(1)小组同学依据漂白液具有漂白消毒的性质推测,漂白液中ClO-具有氧化性。实验如下:
Ⅰ. 用pH计检验,漂白液pH>7,饱和KAl(SO4)2溶液pH<7。
Ⅱ. 取10 mL漂白液,依次加入Na2SO3溶液和BaCl2溶液,有白色沉淀生成,经检验白色沉淀不溶于盐酸。
Ⅲ. 另取10 mL漂白液,加入品红溶液,溶液红色逐渐变浅,一段时间后褪为无色。
Ⅳ. 再取10 mL漂白液,加入品红溶液,加入少量稀硫酸酸化后,溶液红色立即变为无色。
①漂白液pH大于7的原因是(用离子方程式表示)__________。
②由实验Ⅱ得出ClO-具有氧化性,写出反应的离子方程式__________。
③对比实验Ⅲ和Ⅳ说明ClO-氧化性与溶液酸碱性的关系是__________。
(2)小组同学依据(1)中的实验,提出:漂白液在酸性溶液中有Cl2生成。用下图所示的装置继续实验,探究漂白液在酸性溶液中是否能反应生成Cl2。
①装置B的作用是__________;盛放的药品是__________。
②若打开分液漏斗活塞向烧瓶中加入硫酸,不久烧瓶中有黄绿色气体产生。A中反应的离子方程式为 ( )。
③若打开分液漏斗活塞向烧瓶中加入饱和KAl(SO4)2溶液,首先观察到产生大量的白色胶状沉淀,不久烧瓶中有黄绿色气体产生。A中加KAl(SO4)2溶液反应的离子方程式是( )。
(3)上述实验说明漂白液与酸性溶液混合会产生Cl2。若取10 mL漂白液与足量BaCl2溶液混合后,不断通入SO2至过量,在实验过程中可能的实验现象是( )。
正确答案
(1)
①
②
③
(2)
①吸收Cl2 NaOH溶液
②
③
(3)产生白色沉淀,溶液由无色变黄绿色,最后溶液变无色
解析
解析已在路上飞奔,马上就到!
知识点
化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。
I、摩擦剂中氢氧化铝的定性检验
取适量牙膏样品,加水搅拌、过滤。并进行如下实验
(1)请完成表格中的填空:
II、牙膏样品中碳酸钙的定量测定
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。
依据实验过程回答下列问题:
(2)、实验过程中先后两次鼓入空气,第二次鼓入空气的目的是: 。
(3)C中反应生成BaCO3的化学方程式是 。
(4)下列各项措施中,不能提高测定准确度的是 (填标号)。
A,在加入盐酸之前,应排净装置内的CO2气体
B,滴加盐酸不宜过快
C,在A—B之间增添盛有浓硫酸的洗气装置
D,在B—C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(5)实验中准确称取8.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g,则样品中碳酸钙的质量分数为 。
(6)某同学提出将C中的Ba(OH)2换成浓H2SO4 ,通过测定D装置反应前后的质量差也可以测定CaCO3的含量,假设反应前D装置的质量为m1,实验结束后D装置的质量为m2,则样品中CaCO3的质量为 。实验证明按此测定的结果偏高,原因是 。
正确答案
(1)①Al(OH)3+OH―→AlO2― +2H2O ;②有白色沉淀产生
③AlO2―+CO2+2H2O→Al(OH)3↓+HCO3― ;④沉淀溶解,有气体产生
(2)驱赶残留在装置中的CO2 以使生成的CO2完全被吸收
(3)CO2+Ba(OH)2 →BaCO3↓+H2O
(4)CD
(5)0.25(25%)
(6)
D装置吸收反应生成的CO2外,还会吸收挥发出的HCl,同时空气中的H2O和CO2 也会进入D装置。使m2-m1偏大
解析
略
知识点
28.将如下仪器(部分夹持及连接装置巳省略)进行合理组装,既可用于物质制备,又可用于物质的性质验证。请回答下列问题,
(1) 利用装置A、B制取氨气并进行性质实验。分液漏斗中试剂为浓氨水,圆底烧瓶中试剂为生石灰,B中烧杯内试剂为AlCl3溶液。打开分液漏斗旋塞,圆底烧瓶中即有氨气生成,该反应的化学方程式是:_____________________—段时间后,观察到烧杯中的现象是______________;B中球形干燥管的作用是______________。
(2)选择上图部分装置制取SiCl4。已知:
①SiCl4沸点为57.7°C、熔点为-70.0°C,遇水极易水解;
②硅与氯气共热到450〜500°C可反应生成SiCl4;
③
制取四氯化硅正确的装置连接顺序为:A→C→C→_______→_______→_______(填装置序号);前后两次C中所装试剂分别为_______、_______;该连接顺序中最后一个装置的作用是______
(3)选择上图部分装置制取SO2并验证其相关性质。将制得的SO2通入酚酞与NaOH的混合溶液中,可观察到溶液红色褪去。甲认为红色褪去的原因是SO2水溶液呈酸性:乙认为红色褪去的原因是SO2水溶液具有漂白性。在不加热的条件下,试设计一个实验方案,判断甲、乙看法是否正确。简要写出实验步骤及观察到的现象_______。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26.黄铜矿是工业炼铜的主要原料,主要成分为CuFeS2,含少量脉石。为测定该黄铜矿的纯度,某同学设计了如下实验:
用电子天平称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的1/10置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准碘溶液20.00mL。请回答下列问题:
(1)将样品研细后再进行反应,其目的是 ;标准碘溶液应盛放在(填“碱式”或“酸式”) 滴定管中。
(2)装置a的作用是 (填序号)。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
29.某校化学小组的同学开展测定

(1)甲同学用图1所示装置,把Xg的混合物与足量稀硫酸反应后,测定产生的CO2气体的体积。实验开始时检查该装置气密性的方法是( )。
(2)乙同学用图2装置测定CO2的质量,该装置存在明显缺陷,从而导致实验误差,请你分析其中使测定结果可能偏大的主要原因 ( );使测定结果可能偏小的主要原因( ) 。(上述偏大、偏小的原因各写一条)
(3)丙同学用图3代替图1中的发生、收集装置,甲、乙两试管各有两根导管,用耐酸橡胶管连接对应接口后,倒置盛稀硫酸的试管,发生反应,放出气体,则
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
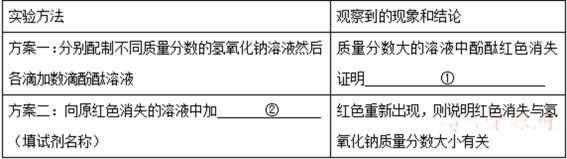
27.甲、乙、丙、丁四位同学在探究“碱溶液与酚酞作用”的实验时,发现了一个意外现象:氢氧化钠溶液滴人酚酞试液,溶液变成了红色,一会儿红色就消失了。
[猜想]
甲:可能是酚酞变质造成的;
乙:可能是氢氧化钠溶液与空气中的二氧化碳反应的缘故;
丙:可能是酚酞与空气中的氧气反应,使红色消失;
丁:可能与氢氧化钠溶液质量分数大小有关。
[理论分析]
(1)甲同学刚提出自己的猜想,就遭到其余三位同学的否定,三位同学的理由是:____________。
(2)丙同学认为乙同学的猜想也不正确,他的理由是_______________。
[实验设计]
(3)为证实丙同学的猜想,还需做如下实验,请完成下表:
(4)通过以上实验,四位同学看到:溶液先变成红色,一会儿红色仍然消失。因此酚酞红色褪去与氧气无关。若丁同学的猜想正确,设计如下实验证明并完成有关问题:
正确答案
(1)若酚酞变质,遇NaOH溶液就不会显红色。
(2)因为NaOH与空气中的CO2反应后的产物是Na2CO3,溶液仍然呈碱性。
(3)① 除去溶液的氧气 ② 利用植物油隔绝空气
(4)① 红色消失与氢氧化钠的质量分数大小有关 ② 水
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析