- 化学实验方案的设计与评价
- 共98题
insure
正确答案
30.金属铝、铁、铜及其化合物与生产、科研关系密切。
(1)工业上可用铝与软锰矿(主要成分为MnO2)反应冶炼金属锰。用化学方程式表示其冶炼原理___________________________。
(2)工业上,采用石墨、铁棒作为电极,电解除去废水中的CN-(C为+4价。下同),装置如图所示,通电过程中,阴、阳两极均有无色无味的气体产生,阳极区两种离子的放电产物会进一步发生反应,其方程式为C12+CNO-+OH-→□+Cl-+CO32-+H2O(未配平)。
①铁电极应连接直流电源的________________(填写电极名称)。
②上述反应方程式配平后“□”内应填写_______。
③阳极上发生的电极反应为2Cl--2e-=Cl2↑和______。
(3)用 CuSO4溶液为电解质溶液,进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼。下列说法错误的是___________(填写字母代号)。
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(4)硫酸铝铵水溶液呈酸性,是因为__________(填写离子符号)发生了水解;常温下浓度均为0.1 mol·L-1硫酸铝和硫酸铝铵两种水溶液,c(Al3+)较大的是________(填“硫酸铝铵”或“硫酸铝”)溶液。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
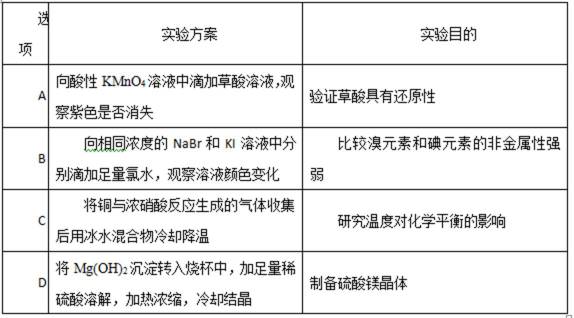
12.下列实验方案不能达到实验目的的是
正确答案
解析
A.抓住高锰酸钾的常规考察点:强氧化性;理解书本实验高锰酸钾溶液与草酸反应的背景:草酸具有还原性。
B. 要理解元素非金属性强弱的判断依据,并灵活应用。
C. 熟记NO2与N2O4之间的化学平衡受温度影响的平衡移动过程。
D. 理解Mg2+的水解,哪些因素会使水解程度增大,进而影响到蒸发结晶的产物判断。
考查方向
A.考察高锰酸钾的强氧化性:高锰酸钾溶液褪色,即可证明草酸有还原性。
B. 考察非金属性强弱比较。要想证明溴比碘的非金属强,需设计溴置换碘的实验。
C. 考察NO2与N2O4的平衡转化受温度的影响因素。
D. 考察Mg2+的水解,但要区别MgSO4与MgCl2溶液的不同点。
解题思路
A.高锰酸钾与草酸反应是中学常见反应(选修4,研究反应速率的实验),高锰酸钾溶液褪色,即可证明草酸有还原性。
B.足量氯水都能置换出溴与碘,但不能证明溴的非金属性比碘强。要想证明,需设计溴置换碘的实验。
C. 铜与浓硝酸反应生成NO2,NO2与N2O4的转化是化学平衡中的基本知识。
D. 氢氧化镁能溶于稀硫酸,蒸发浓缩结晶能得到硫酸镁晶体。硫酸镁溶液蒸发时,不需要考虑Mg2+的水解,要区别MgSO4与MgCl2溶液在蒸发浓缩时Mg2+水解的不同点。
易错点
B选项只能证明氯的非金属性比溴强,氯的非金属性比碘强,不能证明溴与碘之间的关系。
教师点评
综合考察几个小实验,有课本上的基础实验,有基于反应原理而设置的实验,需要有一定的综合理解能力,才能很好的完成判断。
知识点
12.下列实验设计方法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
25. 某化学研究小组为测定Na2O2样品(仅含Na2O杂质)的纯度,设计了两种实验方案进行探究。
[实验一] 取样品0. 100 g,用右图所示实验装置进行测定。

(1)检查装置A气密性的方法是( ) 。
(2)若在实验过程中共产生气体11.20 mL(已折算成标准
状况),则样品中Na2O2的纯度为( )。
[实验二] 样品溶于水后用盐酸滴定
(3)取一定量样品溶于水并配制成250 mL溶液,配制时,所用到的玻璃仪器除了烧杯和玻璃棒外,还需用到( ) 。
(4)取上述所配溶液各25.00 mL,用一定浓度的标准盐酸滴定,平行实验记录如下表:
由表中数据可知,标准盐酸体积的平均值为 ( ) mL。若滴定前用上述所配溶液润洗锥形瓶,对实验测定结果产生的影响是( )(填“偏高”、“偏低”或“无影响”)。
[实验分析] 实验结果对比分析
(5)小组同学对比两个实验发现,实验一测得的Na2O2样品的纯度比理论值明显偏小。经过分析,小组同学认为,明显偏差不是由操作失误和装置缺陷引起的,可能是反应原理上的原因。查阅资料发现:Na2O2与水反应产生的H2O2未完全分解。
①写出Na2O2与水生成H2O2的化学方程式( ) 。
②若将实验一稍加改进,就能使测定结果接近理论值,写出改进方案:( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
16. (7分)(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________。
A. KMnO4 B. H2O2 C. Cl2 水 D. HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去
Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________。
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
7.下列装置能达到相应实验目的的是
正确答案
解析
A. 因盐酸易挥发,不能排除盐酸的干扰,则不能比较碳酸、硅酸的酸性强弱,可用稀硫酸代替浓盐酸进行实验,故A错误
B.苯与酒精互溶,无法通过分页操作进行分离,故B错误
C. 过氧化钠与水反应生成氢氧化钠和氧气,可用于制取少量的氧气,故C正确
D. 二氧化氮与水反应,不能用排水法收集,故D错误
故本题选择C
考查方向
解题思路
A.因盐酸易挥发,不能排除盐酸的干扰
B.苯与酒精混溶,不会分层
C.过氧化钠与水反应生成氢氧化钠和氧气
D.二氧化氮与水反应,不能用排水法收集
易错点
不会用强酸制弱酸原理比较酸性的强弱
知识点
2.下列有关实验操作的叙述错误的是( )
正确答案
解析
A.过滤遵循一贴二低三靠,则过滤操作中,漏斗的尖端应接触烧杯内壁,防止液滴飞溅,故A正确;B.玻璃棒蘸取待测液,滴在pH试纸上,试纸不能湿润,湿润的pH试纸测定醋酸的pH偏大,故B错误;C.滴定管用所盛装的反应液润洗,否则浓度变小,则润洗2~3 次,故C正确;D.分液时避免上下层液体混合,则下层液体从下端放出,上层液体从上口倒出,故D正确;故选B.
考查方向
解题思路
A.过滤遵循一贴二低三靠;B.玻璃棒蘸取待测液,滴在pH试纸上,试纸不能湿润;C.滴定管用所盛装的反应液润洗,否则浓度变小;D.分液时避免上下层液体混合.
易错点
混淆实验操作要点
知识点
扫码查看完整答案与解析