- 根据化合价正确书写化学式(分子式)
- 共24题
12.取pH值均等于1的盐酸和醋酸各100mL分别加水稀释到10倍后,再分别加入0.03g锌粉,在相同条件下充分反应,有关叙述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
25.FeCl2·4H2O可直接用于污水处理,作为还原剂和媒染剂,广泛用于印染、制造、医药和冶金等行业。某化学探究小组进行了FeCl2·4H2O的制备、结晶水含量测定的探究实验。
FeCl2·4H2O的制备:在一定浓度的盐酸溶液中,逐渐加入一定量的铁屑进行加热保温反应。经冷却、过滤、蒸发、趁热过滤、冷却结晶、固液分离、快速干燥制得。
(1)在蒸发、趁热过滤过程中必须采取的措施及理由是________________________。
(2)利用下图装置对所获晶体(FeCl2•nH2O)中结晶水的含量进行测定。

装置A是用浓盐酸和石灰石反应制取二氧化碳的装置,并希望能“随开随用、随关随停”,下图中可选用的发生装置是________(填写字母)。
该实验中选用浓盐酸和石灰石反应制取二氧化碳的理由是____________________。
(3)上述实验测定的实验数据记录如下:
若无需再进行第三次称量,则W的数值应为___________________。
计算n的实测值为_________(保留二位小数),相对误差为________(保留二位小数)。
正确答案
(1)在滤液中加入少许洗净的铁块,防止生成的氯化亚铁被氧化
(2)ac ;通过产生的CO2排尽装置中的空气,防止Fe2+被氧化;通过浓盐酸挥发出的氯化氢抑制Fe2+的水解
(3)84.028(或者84.027;84.029); 3.94;-1.50%
解析
解析已在路上飞奔,马上就到!
知识点
6.一定条件下,可逆反应C(s)+CO2(g)
①升高反应体系的温度;
②增加反应物C的用量;
③缩小反应体系的体积:
④减少体系中CO的量。
上述措施中一定能使反应的正反应速率显著加快的( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
8.下列表格中的图示内容符合要求的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
31.某兴趣小组设计如图装置制取SO2,研究其性质,并进一步探究在适当温度和催化剂的条件下,SO2与O2反应后混合气体的成分。
(1)仪器G的名称是_________________。
(2)B、C、D分别用于检验SO2的漂白性、还原性和氧化性。则C中反应的离子方程式为__________________________,证明SO2有氧化性的实验现象是___________________.
(3)为了实现绿色环保的目标,某同学设计装置F来代替装置A。与装置A相比,装置F的优点是____________________________(写出2点)。
(4)若选用装置F制取O2,可选用试剂_______________。
(5)该小组同学设计如下装置来检验SO2与O2反应后混合气体的成分。
已知:SO3遇水剧烈反应,放出大量热。产生酸雾;98.3%的H2SO4可以吸收SO3和酸雾。
供选试剂:蒸馏水、0.5 mol·L-1BaCl2溶液、98.3%的H2SO4、2.0 mol·L-1 NaOH溶液、KMnO4溶液。
② c中应选用的试剂是_________,e中试剂的作用是__________,f中收集的气体是____________。
②某同学提出用饱和NaHSO3溶液代替98.3%的H2SO4,请你评价该方案是否可行, 若可以不必说明理由:若不可行。简述其理由__________。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
8.元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,R元素原子最外层电子数等于其电子层数的3倍,下列判断正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
5. 化学家借助太阳能产生的电能和热能,用空气和水作原料成功地合成了氨气。下列有关说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26.某溶液中的溶质由下列中的几种离子构成:Na+、Fe3+、Cu2+、Ba2+、AlO2—、CO32—、SO32—、SO42—。取该溶液进行有关实验,实验步骤及结果如下:
①向溶液中加入过量稀盐酸,得到气体甲和溶液甲;
②向溶液甲中加入过量NH4HCO3溶液,得到白色沉淀乙、气体乙和溶液乙;
③向溶液乙中加入过量Ba(OH) 2溶液,得到白色沉淀丙、气体丙和溶液丙。
④检验气体甲、气体乙、气体丙,都只含有一种成份,而且各不相同。
请回答下列问题:
(1)只根据实验①能得出的结论是:( );
(2)沉淀丙中一定含有:( ),可能含有:( );
(3)该溶液中肯定存在的离子有:( );
(4)气体乙分子的结构式为( );
(5)向溶液甲中加入NH4HCO3溶液至过量,该过程中可能发生反应的离子方程式为( );( );( )(根据需要,可不填完,也可
正确答案
(1)至少含有

(2)BaCO3; BaSO4
(3)
(4)O=C=O
(5)
解析
解析已在路上飞奔,马上就到!
知识点
24.(1)常温下,已知0.1 mol·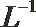
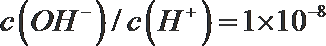
①pH=3的HA与pH=l1的NaOH溶液等体积混合;反应的离子方程式为______________;混合溶液中,各离子的物质的量浓度大小关系是____________;
②0.2 mo·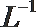
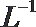
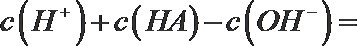
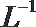
(2)t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数Kw=___________。
①该温度下(t℃),将100mL0.1 mol·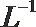
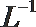
②该温度下(t℃),1体积的稀硫酸和10体积的NaOH溶液混合后溶液呈中性,则稀硫酸的pH(pHa)与NaOH溶液的pH(pHb)的关系是_______________。
正确答案
(1)
①3 , HA+OH-=A-+H2O c(A-)>c(Na+)>c(H+)>c(OH-)
②0.05
(2)10-13
①12
② pHa+pHb=12
解析
解析已在路上飞奔,马上就到!
知识点
29.Ⅰ.铁及其化合物在生活、生产中有广泛应用。请回答下列问题。
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2
(2)氯化铁溶液称为化学试剂中的“多面手”,写出SO2通入氯化铁溶液中反应的离子方程式:( )。
(3)研究性学习小组对某硫酸亚铁晶体(FeSO4•xH2O)热分解研究,该小组同学称取ag硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B质量测出x的值。
①装置B中硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有( )。
②实验中要持续通入氮气,否则测出的x会( )(填“偏大”、“偏小”或“不变”)。
硫酸亚铁晶体完全分解后装置A中还残留红棕色固体Fe2O3。
③从理论上分析得出硫酸亚铁分解还生成另一物质SO3,写出FeSO4分解的化学方程式( )。
④装置D球形干燥管的作用( ) 。
⑤某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4•xH2O)进行热分解,获得相关数据,绘制成固体质量——分解温度的关系图如图2,根据图2中有关数据,可计算出FeSO4•xH2O中的x=( )。
II.锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料,制备MnO2的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为( )。现以铅蓄电池为电源电解酸化的MnSO4溶液,如图所示,铅蓄电池的总反应方程式为( )。
正确答案
I.
(1)32
(2)2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
(3)
①SO2
②偏小
③2FeSO4
④吸收尾气并防倒吸
⑤x= 7
Ⅱ.Mn2+-2e一+2H2O=MnO2+4H+ Pb+PbO2+2H2SO4=2PbSO4+2H2O
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析













