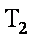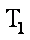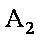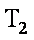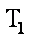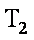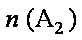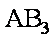- 反应速率的定量表示方法
- 共55题
在100℃时,将N2O4、NO2分别充入两个各为1 L的密闭容器中,反应过程中浓度变化如下:[2NO2(g) 
下列说法正确的是
正确答案
解析
略
知识点
研究NO2、NO、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为 _____________ 。
利用反应6NO2(g)+ 8NH3(g)
则化学平衡常数表达式K= _____________- ;
当转移1.2mol电子时,消耗的NO2在标准状况下是 _____________ L。
(2) 汽车尾气中含有NO和CO气体,对环境有影响。已知平衡常数K的值大小,是衡量化学反应进行程度的标志。在25℃时,下列反应及平衡常数如下
2NO(g) 
2CO(g)+O2(g) 
为了完成汽车尾气处理装置的改造,除去氮氧化物、一氧化碳污染气体,根据上述有关数据判断,下列说法正确的是
A. 改造后的尾气装置使用高温高压,可大量减少污染气体的排放
B. 汽车尾气中氮氧化物在空气中会自动的转化为氮肥,对植物生长有益,可不必除去
C. 改造后的尾气装置使用催化剂,可大量减少污染气体的排放
D. 根据K1和 K2的数据,尾气中NO和CO可自行转化为无害气体
(3) 一定条件下将CO和H2O发生反应,可减少CO对环境的影响。若在700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) 
反应过程中测定的部分数据见下表(表中t1>t2):
反应在t1min内的平均速率为v(H2)= ________mol·L-1·min-1
保持其他条件不变,起始时向容器中充入2.40molCO和1.20 molH2O,到达平衡时,
n(CO2) _______0.80 mol(填:大于、小于、等于)。
(4)酸雨是大气污染的危害之一,二氧化硫(SO2)的含量是空气质量监测的一个重要指标。某兴趣小组同学收集某地的雨水进行实验,每隔1h,通过pH计测定雨水样品的pH,测得的结果如下表:
请写出上述PH变化的原因(用化学方程式表示)_______________________________.
正确答案
(1)3NO2+H2O →2HNO3+NO ; K=[N2]7[H2O]12/[NO2]6[NH3]8 ;6.72
(2)c
(3)0.2/t1 ;等于
(4)2H2SO3 +O2 → 2H2SO4
解析
略
知识点
氢气被誉为21世纪的新型清洁能源,能有效降低二氧化碳的排放。以甲醇为原料经过重整可以获得氢气。其工业流程如下:
请回答以下问题:
(1)液态甲醇雾化后与水蒸气混合,其目的是______;该工业流程中可以循环利用的物质是______(填名称)。
(2)为了测定CH3OH(g) + H2O(g) → CO2(g) + 3H2(g)的反应速率,在某温度下用气体传感器测得不同时间的甲醇和水蒸气浓度如下:
(i)前2s内的平均反应速率v(H2)=___________
(ii)在该温度下,反应的平衡常数表达式K=_________
(3)为了研究反应条件对CO含量的影响,在甲醇含量为50%,原料液进料量60mL/h的情况下,在常压下和在不同催化环境下得到了反应温度与CO含量的关系图。从图中得到的有关结论是_______________________(写出其中一个即可)
(4)为研究反应中压强对CO含量的影响,请简述你的实验方案:__________________;
正确答案
(1)让反应物充分接触,加快反应速率。 一氧化碳
(2) 1.125X10-3 mol/(LS)
K= ([H2]3[CO2] )/([CH3OH][H2O])
(3)最佳反应温度230℃
(4)在甲醇含量为50%,原料液进料量60mL/h ,温度一定情况下,测定不同压强下CO 含量
解析
略
知识点
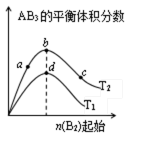
12. 某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g) 2AB3(g)化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是( )
正确答案
解析
略
知识点
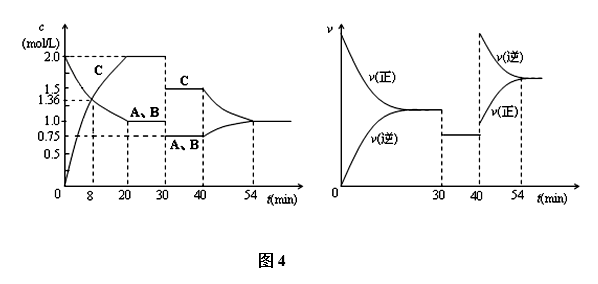
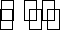
13.某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应是: 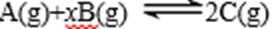
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
29.某化学反应
根据上述数据,完成下列填空:
(1)实验1中,在10~20 min时间内,以A的速率表示的平均反应速率为 ( )。
(2)实验2中,A的初始浓度c2= ( )
(3)测得实验2和实验3各组分百分含量相等。设实验3的化学反应速率为v3,实验1的化学反应速率为v1,则v3 ( ) v1(填“>”“=”或“<”),且c3=( )
(4)实验4和实验1仅起始温度不同。比较实验4和实验1,可推测该反应的正反应是( )反应(填“吸热”或“放热”),理由是( )。
(5)实验4中,假定在50 min将容器的容积缩小为原来的一半,请在下图中用曲线表示体系中各物质的浓度随时间变化的趋势(曲线上必须标出A、B、D)。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.甲醇来源丰富,价格低廉,是一种重要的化工原料,有着非常重要、广泛的用途。工业上通常用水煤气在恒容、催化剂和加热的条件下生产甲醇,其热化学方程式为:2H2(g)+CO(g)
(1)该反应的平衡常数表达式为:K= ,如升高温度,K值将 (填:增大、减小或不变)。
(2)以下各项不能说明该反应达到平衡状态的是 .
(3)在2100C、2400C和2700C三种不同温度、2 L恒容密闭容器中研究合成甲醇的规律。
(4)某兴趣小组设计了如图所示的甲醇燃料电池装置。
② 该电池工作时,正极是 极(填“a”或“b”);
②该电池负极反应的离子方程式为 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27. A、B、C、D都是中学化学中的常见化合物,均由周期表前18号元素组成,D为红综色气体,甲、乙则是两种单质,以上单质和化合物之间在如图1所示的反应关系(反应物和生成物均无省略)。
请回答下列问题:
(1)图1所示转化过程中包含的反应类型有( )(填字母)。
a.置换反应 b.复分解反应 c.分解反应 d.化合反应
(2)物质B的电子式为( );图1中反应①的化学方程式是( ) 。
(3)图1中反应③在一定条件下为可逆反应,反应的能量变化如图2所示,当该反应处于平衡状态时,下列措施中有利于提高C的平衡转化率的是( )(填字母)。
A.升高温度 B.降低温度 C.增大压强
D.减小压强 E.加入催化剂 F.增加C的量
(4)若将l mol甲和2 mol C混合充入容积为2 L的密闭容器中,3分钟后反应达到平衡。平衡后混合气体总物质的量为2.55mol,则用甲表示的化学反应速率为( ) 
(5)若对(4)中的1 mol甲和2 mol C的混和气体分别只改变一个实验条件(温度、压强、催化剂)后,得到D的物质的量随时间的变化曲线①和②(如图3所示),则曲线①、②所改变的具体实验条件分别是:① ( );② ( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.密闭容器中X、Y、Z三种气体的初始浓度和不同温度下的平衡浓度如下表:下列说法错误的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
29.某同学欲探究
请回答下列问题:
(1)用pH试纸测定溶液pH的操作方法是( );
(2)写出生成白色沉淀W所涉及的离子方程式( );
(3)写出
(4)取三支大小相同的试管,通过测定
①V=( );
②探究浓度对化学反应速率的影响,应选择( )(填实验编号)组实验进行对比分析;
③为了准确控制反应的温度,应采用的加热方式为( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析