- 热化学方程式
- 共127题
近年来,由于温室效应和资源短缺等问题,关于CO2和碳酸盐应用的研究受到人们的重视。某研究小组利用反应:CO(g)+H2O(g) 
(1) 已知:850℃时在一体积为10 L的恒容密闭容器中,通入一定量的CO和H2O,CO和H2O浓度变化如图所示:
下列说法正确的是_______(填序号)
A. 达到平衡时,氢气的物质的量是0.12mol
B. 达到平衡时,反应体系最终会放出49.44kJ热量
C. 第4min始,混合气体的平均相对分子质量不再变化
D. 第6min时,若升高温度,反应平衡常数会减小
E. 第8min时,若充入氦气,会导致v正(CO)<v逆(H2O)
(2) 850 ℃时,若在容积为2 L的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2和x mol H2。若要使上述反应开始时向正反应方向进行,则x应满足的条件是_______。
(3)研究小组采用碱液吸收一定量CO2的方法来提高混合气中H2与CO2的体积比。若以1L1.5 mol·L-1的NaOH溶液充分吸收了22.4L(已折算为标准状况下体积)CO2,则吸收后溶液中各离子浓度从大到小的顺序是_______。
(4) 如将H2 与CO2以4:1的体积比混合,在适当的条件下可制得CH4。已知:
CH4 (g) + 2O2(g) 
H2(g) + 1/2O2(g) 
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是 _______。
(5) 熔融盐燃料电池(见图2)是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。已知负极的电极反应是CH4 +4CO32--8e-=5CO2+2H2O。正极的电极反应是_______。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此电池工作时必须有部分A物质参加循环,则A物质的化学式是_______。实验过程中,若通入了标准状况下空气448 L(假设空气中O2体积分数为20%),则熔融盐燃料电池消耗标准状况下CH4_______L。
正确答案
(1)BD
(2)3>x≥0或 x<3
(3)c(Na+)> c(HCO3-)> c(CO32-)> c(OH-)> c(H+)
(4)CO2(g) + 4H2(g) 
(5)O2+2CO2+4e-=2CO32-(或2O2+4CO2+8e-=4CO32-);CO2;44.8
解析
(1)由图像看出,反应在4min达到平衡,平衡时消耗H2O、CO的物质的量浓度均为0.12 mol·L-1,故生成的H2和CO2的物质的量浓度也为0.12 mol·L-1,其物质的量为1.2mol,A项错误;有1.2molH2O参加反应,根据热化学方程式可计算放出的热量为1.2mol×41.2 kJ·mol-1=49.44kJ,B项正确;由于该反应体系中全部是气体,且气体物质的量不变,故混合气体的平均相对分子质量是恒量,不会随反应的进行而变化,C项错误;该反应为放热反应,升温平衡左移,化学平衡常数减小,D项正确;氦气为惰性气体,不会影响该反应的平衡状态,E项错误。
(2)若要使上述反应开始时向正反应方向进行,其浓度商应小于该温度下的平衡常数,即Q=<K= 解得x<3。
(3)通入CO2反应后所得溶液为等物质的量浓度的Na2CO3和NaHCO3的混合溶液,故其离子浓度大小顺序为c(Na+)> c(HCO3-)> c(CO32-)> c(OH-)> c(H+)。
(4)将已知的两个热化学方程式按顺序编号为①②,根据盖斯定律②×4-①可得热化学方程式:CO2(g) + 4H2(g) 
(5)写出电池总反应方程式CH4+2O2=CO2+2H2O,减去负极的电极方程式可得正极电极方程式:2O2+4CO2+8e-=4CO32-;由正、负极电极式看出,参与循环的物质为CO2;由电池总方程式可得:消耗CH4的体积为448L××=44.8L。
知识点
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM25(直径小于等于2.5
请回答下列问题:
(1)将PM25样本用蒸馏水处理制成待测试样。
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据判断PM25的酸碱性为 ,试样的pH= 。
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+


写出焦炭与水蒸气反应的热化学方程式: 。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是 。
a。Ca(CH)2 b。Na2CO3 c。CaCl2 d。NaHSO3
(3)汽车尾气中NOx和CO的生成及转化
①已知汽缸中生成NO的反应为:


若1mol空气含0.8molN2和0.2molO2,1300oC时在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K= 。
汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g)
已知该反应的△H
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为
。
正确答案
见解析
解析
解析:。
知识点
元素周期表中第VIIA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子结构示意图为_______。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是_______(填序号)。
a. Cl2、Br2、I2的熔点
b. Cl2、Br2、I2的氧化性
c. HCl、HBr、HI的热稳定性
d. HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液

①完成I中反应的总化学方程式:___NaCl+___H2O=___NaClO3+___ _______。
②II中转化的基本反应类型是_______,该反应过程能析出KClO3晶体而无其它晶体析出的原因是_______。
(4)一定条件,在水溶液中1 mol Cl-、ClO-(x=1,2,3,4)的能量(KJ)相对大小如右图所示。
①D是_______(填离子符号)。
②B→A+C反应的热化学方程式为_______(用离子符号表示)。
正确答案
(1)
(2)b、c
(3)①1NaCl+3H2O=1NaClO3+3H2↑;②复分解反应;室温下,氯酸钾在水中的溶解度明显小于其它晶体
(4)①ClO4-;②3ClO-(aq)=ClO3-;(aq)+2Cl-(aq),ΔH=-117KJ·mol-1
解析
略。
知识点
元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是 。
a,原子序数和离子半径均减小 b,金属性减弱,非金属性增强
c,氧化物对应的水合物碱性减弱,酸性增强 d,单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为 ,氧化性最弱的简单阳离子是 。
(3)已知:
工业制镁时,电解MgCl2而不电解MgO的原因是 ;制铝时,电解Al2O3而不电解AlCl3的原因是 。
(4)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:
写出SiCl4的电子式: ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式: 。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是 。
a, NH3 b, HI c, SO2 d ,CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式: 。
正确答案
(1)b
(2)氩 
(3)

(4)


(5)b
(6)
解析
略
知识点
某小组根据工业生产原理设计如下转化关系,以获取烧碱和金属钛(Ti)。
(1) 燃料电池中通入氧气的电极是 (填“正”或“负”)极,电极反应式是 ;用该电池电解饱和食盐水,若消耗32 g甲醇,理论上Ⅰ中可生成NaOH ________mol。
(2)如图所示,理论上加入Ⅱ中的TiO2和焦炭的物质的量之比是 ;由TiCl4得到金属Ti的化学方程式是 。
(3)根据Ⅲ中合成甲醇的反应,该小组保持温度不变,在两个相同的恒容密闭容器中进行实验,有关实验数据如下:
① P1 4MPa(填“>”、“<”或“=”);
② 实验Ⅰ条件下合成甲醇的热化学方程式是 。
正确答案
见解析。
解析
(1)正 
(2)1﹕2
(3)①<
②
知识点
污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某化学研究小组利用软锰矿(主要成分为MnO2,另含有少量头铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已略去)。
请回答下列问题:
(1)上述流程脱硫实现了____(选填下列字母编号)。
a,废弃物的综合利用 b,白色污染的减少 c ,酸雨的减少
(2)用MnCO3能除去溶液中Al3+和Fe3+,其原因是_____。
(3)已知:25℃、101kpa时,Mn(s)+O2(g)=MnO2(s) △H=-520kJ/mol
S(s)+O2(g)=SO2(g) △H=-297kJ/mol
Mn(s)+S(s)+2O2(g)=MnSO4(s) △H=-1065kJ/mol
SO2与MnO2反应生成无水MnSO4的热化学方程式是________________。
(4)MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是_ _。
(5)MnO2是碱性锌锰电池的正极材料。碱性锌锰电池放电时,正极的电极反应式是______。
(6)假设脱除的SO2只与软锰矿浆中的MnO2反应。按照图示流程,将a m3(标准状况)含SO2的体积分数为b%的尾气通入矿浆,若SO2的脱除率为89.6%,最终得到MnO2的质量为c kg,则除去铁、铝、铜、镍等杂质时,所引入的锰元素相当于MnO2___________kg。
正确答案
(1)a,c
(2)消耗溶液中的酸,促进 Al3+和 Fe3+水解生成氢氧化物沉淀
(3)MnO2(s) + SO2(g)=MnSO4(s) ΔH=-248 KJ/mol
(4)Mn2++2H2O - 2e-=MnO2 + 4H+
(5)MnO2 + H2O + e-=MnO(OH) + OH-
(6)
解析
(1)B 中的白色污染主要是由于过度使用塑料引起的
(2)MnCO3 消耗溶液中酸,使 Al3+和 Fe3+的水解反应正向移动,形成氢氧化物沉淀
(3)③—①—②,注意状态、符号
(4)阳极为 Mn2+失电子,电极方程式:Mn2++2H2O - 2e-=MnO2 + 4H+
(5)正极得电子,电极方程式为 MnO2 + H2O + e-=MnO(OH) + OH-
(6)由电子守恒可知,MnO2 中的 Mn 元素只有 3/5 来自 MnSO4,可由数据得到 MnSO4 中 Mn 的量。MnSO4 中的 Mn 元素一部分是 SO2 与 MnO2 反应得来,可由题中数据算出,另一部分来自除杂过程中含Mn 的物质,可根据上诉 Mn 元素守恒求得。再除以 Mn 在 MnO2 中所占质量分数,即可得到答案
知识点
工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
某小组研究在相同温度下该反应过程中的能量变化。他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:

“小于”或“等于”)生成物分子化学键形成时所释放的总能量。
(2)容器①中反应达平衡时,CO的转化率为 %。
(3)计算容器②中反应的平衡常数K= 。
(4)下列叙述正确的是 (填字母序号)。
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q > 65.6 kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.容器①中,反应的化学反应速率为:
(5)已知:2H2 (g) + O2 (g) == 2H2O (g) ΔH=-484 kJ/mol,写出CO完全燃烧生成CO2
的热化学方程式: 。
(6)容器①中反应进行到t min时,测得混合气体中CO2的物质的量为0.6 mol。若用
200 mL 5 mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方
程式表示) 。
正确答案
见解析。
解析
(1)小于
(2)80
(3)1
(4)a
(5)2CO(g) + O2(g) === 2CO2(g) △H = -566 kJ/mol
(6)3CO2 + 5OH- === 2CO32- + HCO3- + 2H2O
知识点
NOx是汽车尾气中的主要污染物之一。
(1) NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:_ .
(2)汽车发动机工作时会引发N2和02反应,其能量变化示意图如下:
①写出该反应的热化学方程式: _ .
②随温度升高,该反应化学平衡常数的变化趋势是_ .。
(3)在汽车尾气系统中装置催化转化器,可有效降低NOX的排放。
①当尾气中空气不足时,NOX在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:_ .
② 当尾气中空气过量时,催化转化器中的金属氧化物吸收NOX生成盐。其吸收能力顺序如下:12MgO <2oCaO <38SrO<56BaO.原因是 .,元素的金属性逐渐增强,金属氧化物对NOX的吸收能力逐渐增强。
(4)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
①Pt电极上发生的是 反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式: 。
正确答案
答案:(1)3NO2+2H2O=2HNO3+NO;
(2)①、N2(g)+O2(g)=2NO(g) △H=+183KJ/mol;
②、增大;
(3)①、2NO+2CO
②、由Mg、Ca、Sr、Ba的质子数可知,它们均处于第ⅡA族,同一主族自上而下,原子半径增大;
(4)①、还原;
②、NO+O2--2e-=NO2;
解析
(1)NO2与H2O反应生成HNO3与NO;
(2)①、△H=945kJ/mol+498kJ/mol-2×630KJ/mol=+183KJ/mol;
②、该反应正反应是吸热反应,升高温度,平衡向正反应移动,化学平衡常数增大;
(3)①、NO被CO还原N2,CO被氧化为CO2;
②、由Mg、Ca、Sr、Ba的质子数可知,它们均处于第ⅡA族,同一主族自上而下,原子半径增大,金属性增强;
(4)①、由工作原理示意图可知,O2在Pt电极发生还原反应生成O2-;
②、在O2-参加反应下,NO在NiO电极发生氧化反应生成NO2。
知识点
工业上以粗食盐(含有少量Ca2+、Mg2+杂质)、氨、石灰石等为原料,可以制备Na2CO3。其过程如下图所示。
请回答:
(1)在处理粗盐水的过程中,可加入石灰乳和纯碱作为沉淀剂,则所得滤渣的成分
除过量的沉淀剂外还有 。
(2)将CaO投入含有大量的NH4Cl的母液中,能生成可循环使用的NH3,该反应的
化学方程式是 。
(3)向饱和食盐水中首先通入的气体是 ,过程Ⅲ中生成NaHCO3晶体的反
应的化学方程式是 。
(4)碳酸钠晶体失水的能量变化示意图如下:
Na2CO3·H2O (s) 脱水反应的热化学方程式是 。
(5)产品纯碱中常含有NaCl。取a g混合物与足量稀盐酸充分反应,加热、蒸干、
灼烧,得b g固体。则该产品中Na2CO3的质量分数是 。
(6)熔融Na2CO3可作甲烷——空气燃料电池的电解质,该电池负极的反应式
是 。
正确答案
见解析。
解析
(1)CaCO3、Mg(OH)2
(2)2NH4Cl+CaO=CaCl2+2NH3↑+H2O
(3)NH3 NH3+H2O+CO2+NaCl =NaHCO3↓+NH4Cl
(4)Na2CO3·H2O(s)= Na2CO3(s) +H2O(g) ΔH = + 58.73 kJ·mol-1
(5)106(b-a)/11a
(6)CH4-8e-+4CO32-=5CO2+2H2O
知识点
11.为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(铁主要以Fe2O3存在)转变成重要的工业原料FeSO4(反应条件略)
活化硫铁矿还原Fe2+的主要反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其他反应,请回答下列问题:
(1)第1步H2SO4与Fe2O3反应的离子方程式是( )。
(2)检验第II步中Fe3+是否完全还原,应选择( ) (填字母编号)。
A.KMnO4溶液
B.K2[Fe(CN)4]溶液
C.KSCN溶液
(3)第III步加FeCO3调溶液pH到5.8左右,然后再第VI步通入空气使溶液pH降到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质除尽。通入空气引起溶液pH降低的原因是( )。
(4)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
(5)已知25℃,101kPa时:4Fe(s)+3O2(g)=2Fe2O3(s) 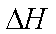
C(s)+O2(g)=CO2(g) 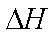
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) 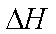
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是( )。
(6)加入烧渣中的铁全部视为Fe2O3,其含量为50%。将a kg质量分数为b%的硫酸加入到c kg烧渣中浸取,铁的浸取率为96%,其他杂质浸出消耗掉饿硫酸以及调pH后溶液呈微酸性所残留的硫酸忽略不计。按上述流程,第III步应加入FeCO3 ( )kg。
正确答案
(1)Fe2O3+6H+=2Fe3++3H2O
(2)C
(3)Fe2+被氧化为Fe3+,Fe3+水解产生H+。
(4)4FeCO3(s)+O2(g) =2Fe2O3(s)+ 4CO2(g) 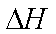
(5)FeS2+4Li++4e-= Fe+2 Li2S或FeS2+4e-= Fe +2S2-
(6)0.0118ab-0.646c或-kg。
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析























