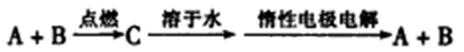- 无机物的推断
- 共127题
26.下图所示转化关系中(部分生成物未列出),反应①、②是生产C、E两种重要工业产品的主要反应。其中C是由两种元素组成的新型陶瓷,被广泛用于陶瓷工业、电子工业;E是一种有刺激性气味的气体,是生产某些化肥、制造纯碱的原料;A、B、G均为非金属单质,Ⅰ是常见金属单质,其余均为化合物;H是氯碱工业的主要产品之一。
请填写下列空白:
(1)H的化学式为______; E的电子式为__________。
(2)一氧化碳(CO)和F是汽车尾气的部分有害成分,它们在催化剂存在下反应生成两种无毒气体,其反应的化学方程式为 _____________ 。
(3)工业上利用反应①生产C的化学方程式为 ____________ 。
(4)将标准状况下224mL的E通入l00mL 0.lmol·L-1的盐酸中,反应后的溶液中离子浓度由大到小的顺序为 _____________。
(5)将G和氧气分别通入多孔的两个铂电极,用一定浓度的H水溶液作为电解质溶液构成氢氧燃料电池,负极的电极反应式为________________,OH-向 极移动(填“正”或“负”)。
正确答案

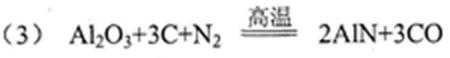
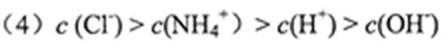
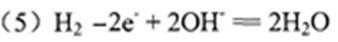
解析
解析已在路上飞奔,马上就到!
知识点
27.下图中,化合物A, B,G,M, L, J 均由两种元素组成,其中A是一种无色液体, G是极易溶于水的常见气体,L分子中的电子数为18(L的相对分子量不超过34)。反应⑤是工业上制X的主要反应之一,化合物H具有强的氧化性,可由常见卤素气体与苛性钾溶液在常温下反应而制得。N的溶液呈浅绿色。(注;有些反应的水也略去)
请按要求填空:
(1)写出下列物质的化学式:
L: ( ▲ ) ,X: ( ▲ ) 。
(2)反应④的离子方程式为: ( ▲ ) 。
(3)反应⑥的离子方程式为: ( ▲ ) 。
(4)略过量的H溶液与N溶液混合有大量的沉淀产生,其离子方程式为:
( ▲ )。
(5)B中F的质量分数为30.77%,
则B的化学式为: ( ▲ ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26.(15分)下图是A~Z在一定条件下的转化关系(部分反应物或产物未列出)。其中,A是生活中广泛使用的金属单质,常温下B是一种常见液体化合物,E、F、X均为气体。物质Y和Na2AO4均有强氧化性,可用于杀菌消毒,Z是一种红褐色固体。
请回答下列问题:
(1)Y的电子式为 ( );A元素在元素周期表中的位置 ( )
反应①的化学方程式是 ( )
(2)在①~⑧中属于氧化还原反应,但又不是化合反应的是 ( )(填序号)
(3)将Y和M的溶液混合后的现象是 ( )
(4)反应⑤的离子方程式是 ( )
(5)若在反应④中转移电子数为2NA,则消耗的F在标准状况下的体积是 ( ) L。
(6)反应⑧的化学方程式是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.甲、乙分别是两种主族元素形成的氧化物,它们广泛存在于地壳中,均不溶于水,且都有如下相同的转化关系,不同之处是乙对应的转化过程中需控制盐酸用量,若盐酸过量则得不到白色沉淀B。
(1) 写出甲、乙的化学式:甲________,乙________;
(2) 写出下列反应的化学方程式:
甲+NaOH溶液____________________________________________,
乙+NaOH溶液____________________________________________;
(3) 分别写出甲、乙对应的A溶液与过量盐酸反应的离子方程式:
甲 ________________________________________
乙____________________________________________
(4) 若将5.1g乙溶于适量的盐酸(二者恰好完全反应)后,再加入175 mL的2 mol.L-1 NH3H2O溶液,得到沉淀___________g
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.已知X是一种盐,H是一种古代劳动人民就已掌握冶炼技术的金属单质,F、P、J是常见的非金属单质,I、E、G都是工业上重要的碱性物质,P和J在一定条件下反应生成I。它们有右图所示的关系,试回答下列问题:
(1)G的化学式为 ________________;
(2)写出下列反应的化学方程式:① ________________;②________________;
(3)某课外小组同学设计了下列实验装置,通过测定某些装置中试剂的质量变化,进一步探究X中各元素的质量关系。
① 为使数据准确,还需补充装置,请你在方框内绘出装置图并写出试剂名称;
② 向装置中鼓入空气的目的是____________________________________________;丙装置中药品的名称为________________,实验时,该药品未见明显变化,证明_________________________________;
③ 如何判断X已完全分解?_______________________________________________________________________________________________________________________________________。
④ 更精确的测定得出如下数据:X受热后完全分解,固体由16.52 g变为12.00 g,装置乙增重1.44 g。写出X的化学式____________。请写出X与盐酸反应的化学方程式为:________________。
(4)L是由3种元素构成的分子,能与I以1∶2的物质的量之比反应生成尿素CO(NH2)2 和物质M,其中M能使硝酸酸化的硝酸银溶液产生白色沉淀,写出L的电子式________________。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13.已知A、B为单质,C为化合物。能实现上述转化关系的是( )
①若C溶于水后得到强碱溶液,则A可能是Na
②若C溶液遇Na2CO3,放出CO2气体,则A可能是H2
③若C溶液中滴加KSCN溶液显红色,则B可能为Fe
④若C溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
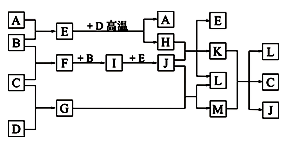
26.如图,常温下单质A、B为气体,单质C为固体,它们依次分别由短周期元素甲、乙、丙组成,甲元素原子核外电子数等于其电子层数,乙、丙同主族;E常温下为液体,G、H为黑色固体,D是常见金属(反应条件多数略去)。
回答下列问题:
(1)化合物E的沸点高于化合M的沸点,原因是( )。
(2)甲、乙两种元素可以形成两种化合物,其中一种化合物含有4个原子核,该化合物的结构式为( )。
(3)E与D高温反应的化学方程式为 ( ) 。
K与M在水溶液中反应的离子方程式为( )。
(4)实验室在保存L溶液时,需加入少量D,理由是( ) 。实验室检验L水溶液中的阳离子的方法是 ( )。
(5)已知一定条件下,每1 mol F与单质B完全反应生成I放出热量98.0 kJ,若2 mol F与1 mol B在此条件下发生反应,达平衡时,放出热量为176.4 kJ,则F的转化率为( )。若保持温度和压强不变(反应混合物都为气体)按下列四种配比作为起始物质充入,达到平衡时各物质的物质的量与上述平衡状态相同的是( )。
① 4 mol F、2 mol B ② 2 mol F、2 mol B、2 mol I
③ 1 mol F、0.5 mol B、1 mol I ④ 3 mol I、1mol Ne
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26.A~L是由6种短周期元素且成的物质,各物质之间有如下转化关系:
已知:
(a)C、E是气体单质,E是一种理想的清洁能源,F是日常生活中的常用金属;
(b)J是能使澄清石灰水变浑浊的无色无味气体;
(c)化合物A、D、I、L的焰色反应显黄色;
(d)白色沉淀K既溶于H溶液,又能溶于D溶液;
(e)反应①是工业上生产D和C的重要方法
请回答下列问题:
(1)写出F的化学式:( ),D的电子式::( )
(2)写出下列有关反应的离子方程::( )
反应①:( );
过量J与I反应:( )
(3)G溶液呈( ) 性(填“酸”、“碱”或“中”),请用离子方程式表示其原因:( )
正确答案
(1)Al 氢氧化钠的电子式
(2)氯化钠溶液的电解和过量二氧化碳与偏铝酸钠溶液生成沉淀和碳酸氢钠离子方程式
(3)酸(这空1分,其余空都为2分)铝离子的水解离子方程式
解析
解析已在路上飞奔,马上就到!
知识点
27.A、B、C、D、E、F六种化合物。其中A、B、C、D、E均由短周期元素组成,焰色反应均呈黄色,B、C、E均由三种元素组成,B、C的组成元素相同,且C的摩尔质量比B大80g/mol请回答下列问题:
(1)固体化合物A为浅黄色粉末,该化合物中含有的化学键为( )(填序号)。
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(2)下表为B与F实验的部分内容:
写出B与稀H2S04反应的离子方程式:( );
写出②中反应的化学方程式:( )。
(3)现由6种粒子Mn2+、MnO4一、H十、H2 0、X2Y82一(C中含有的阴离子)、XY42一完成一个离子方程式,已知Mn2+为还原剂,得到1mol MnO4一需氧化剂的物质的量为( )。
(4)化合物D和E可以相互转化:
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26.(12分)有A、B、C、D、E、F六种元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D、F均为常见金属元素。A原子核内只有一个质子,元素A与B形成的气态化合物甲具有10e-、空间构型为三角锥形,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族。下图中均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应,均含F元素的乙(单质)、丙、丁微粒间(均为无毒离子)的转化全为氧化还原反应。
请回答下列问题:
(1)化合物甲的电子式为( )。
(2)F元素在周期表中的位置( );化合物A2C的稳定性( )(填“大于”、“小于”或“等于”)A2E。
(3)均含有D元素的乙与丁在溶液中发生反应的离子方程式( )。
(4)丙、丁分别是含F元素的简单阳离子,检验含丙丁两种离子的混合溶液中的低价离子,可以用酸性KMnO4溶液,其对应的离子方程式为:( )
(5)已知常温下化合物FE的Ksp=6×10-18,常温下将1.0×10-5mol·L-1的Na2S溶液与含FSO4溶液等体积混合,若有沉淀FE生成,则所需的FSO4的最小浓度为 ( )。(忽略混合后溶液的体积变化)
正确答案
(1)
(2)第四周期第VIII族 ,(2分)大于(2分)
(3)Al3++3AlO2-+6H2O=4Al(OH)3↓(2分)
(4)5Fe2+ + MnO4- + 8H+ = 5Fe3+ + Mn2+ + 4H2O(2分)
(5)2.4×10-12 mol·L-1(2分)
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析