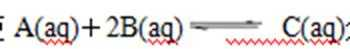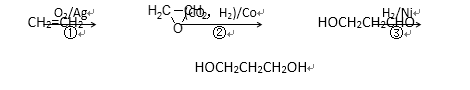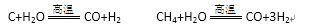- 有关反应热的计算
- 共34题
28.(1)反应
分别在三种不同实验条件下进行,它们的起始浓度均为:c(A)=0.100 mol/L、
c(B)=0.200 mol/L 、 c(C)=0 mol/L。
反应物A的浓度随时间的变化如下图所示。
请回答下列问题:
Ⅰ.与①比较,②和③分别仅改变一种反应条件。
所改变的条件是:②_____________________;
③_____________________。
Ⅱ.实验②平衡时B的转化率为______;
Ⅲ.该反应的ΔH________0;
Ⅳ.该反应进行到4.0min时实验②的平均反应速率:v(B)=_________________;
(2)在一定条件下,二氧化硫和氧气发生如下反应:
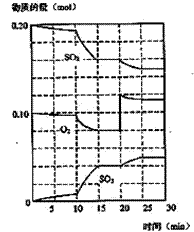

①600℃时,在一密闭容器中,将二氧化硫和氧气混合,反
应过程中SO2、O2、SO3物质的量变化如图,反应处于
平衡状态的时间段 ( )。
②据图判断,反应进行至20min时,曲线发生变化的原因
是(用文字表达)( )
③10min到15min的曲线变化的原因可能是( )
(填写编号)。
a.加了催化剂
b.缩小容器体积
c.降低温度
d.增加SO3的物质的量
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,
其原因是________________________________。
(2)已知:
则方法Ⅰ发生的反应:

(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如下图所示,该电池的阳极反应式为________________________。
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为________________________。又已知肼与氨相似,也能与盐酸反应,则它与足量盐酸反应的化学方程式为________________。
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:

下列叙述正确的是________(填字母代号)。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
9.下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
8.下列叙述错误的是( )
①热稳定性:H2O>HF>H2S
②熔点:AI>Na>K
③ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤多电子原子中,在离核较近的区域内运动的电子能量较高
⑥已知
则中和热△H=-57.3kJ•mol-1
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.利用焦炭或天然气制取廉价的CO和H2,再用于氨合成和有机合成是目前工业生产的重要途径。回答下列问题:
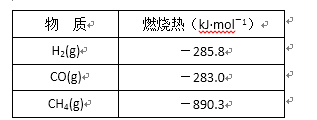
(1)甲烷在高温下与水蒸气反应的化学方程式为:CH4+H2O=CO+3H2。部分物质的燃烧热数据如下表:
已知1 mol H2O(g)转变为1 mol H2O(l)时放出44.0 kJ热量。写出CH4和水蒸气在高温下反
应的热化学方程式 ( )。
(2)500℃、50MPa时,在容积为V L的容器中加入1 mol N2、3 mol H2,,此时N2的转化率为a。则平衡时NH3的浓度为 ( )。
(3)1,3―丙二醇是重要的化工原料,用乙烯合成1,3―丙二醇的路线如下:
某化工厂已购得乙烯11.2 t,考虑到原料的充分利用,反应②、③所需的CO和H2可由以下两个反应获得:
假设在生产过程中,反应①、②、③中各有机物的转化率均为100%。且反应②中CO和H2、反应③中H2的转化率都为80%,计算至少需要焦炭( )吨、甲烷( )吨,才能满足生产需要。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析