- 氮族元素简介
- 共57题
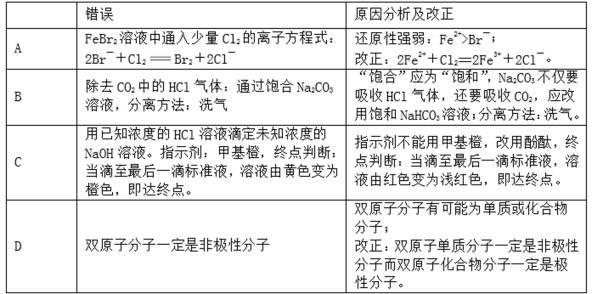
2.小明同学的化学纠错本上有如下内容,其中原因分析及改正有误的是
正确答案
解析
A:还原性Fe2+>Br-,Cl2先与Fe2+反应,对
B:Na2CO3与CO2反应转化成NaHCO3,不可用来洗去CO2中杂质,NaHCO3与HCl反应无新杂质引入,饱和NaHCO3的溶解度较低,可降低CO2的溶解度,对
C:酚酞的变色范围相对石蕊广,应选择石蕊,酚酞呈现浅红色时溶液PH为偏碱性,错
D:只有相同的原子对电子对的引力相同,共用电子对不偏向任何一方呈现非极性,否则呈现极性,对
考查方向
解题思路
Fe2+的还原性大于Br-,Cl2具有很强的氧化性,故Cl2先与Fe2+反应,然后再与Br-反应;Na2CO3可以与CO2反应,在吸收HCl的同时还会吸收CO2,不可以,需要改成不与CO2反应能吸收HCl的试剂,NaHCO3可以吸收HCl产生CO2,可以作为洗气的试剂;三种酸碱指示剂中甲基橙的变色范围:PH=3.1——4.4由红色变为黄色,酚酞的变色范围:PH=8.2——10.0由无色变为红色,故当酚酞变为浅红色时,滴定尚未完全,未达终点,变色范围广,应选用石蕊,其变色范围相对较窄为PH=5.8——8.0由红色变为蓝色,在PH=7.0附近,溶液显紫色,故应选用石蕊作为指示剂;不同的原子对电子对的引力不同,故在不同原子形成的双原子分子中必为极性分子,同种原子引力相同,共用电子对不偏向任何一方,故其双原子分子为非极性分子
易错点
对酸碱指示剂的变色范围模糊不清,氧化性的强弱与还原性强弱的判断失误,以及审题不仔细,导致过量与少量的辩证关系在化学反应中的应用,双原子分子与多原子分子组成的分子中的极性与非极性的判断失误
知识点
7.向甲、乙、丙三个容积固定不变的密闭容器中充入一定量的X和Y,一定条件下发生反应 X(g)+aY(g)
正确答案
解析
因为甲和乙给的体积和起始的物质的量相同,先用三段式表示出各物质的浓度,图表中
曲线图表示的是生成物随时间的变化
根据图表情况和上述三段式分析,甲和乙的温度不同,乙达到平衡的时间短,说明T2>T1,但是甲的Z的浓度比乙大,升高温度,平衡向吸热的反应方向移动,故此反应是一个放热反应。
A:甲和乙的温度不同,乙达到平衡的时间短,说明T2>T1,但是甲的X的转化率比乙少,升高温度,平衡向吸热的反应方向移动,故此反应是一个放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小,所以A对
B:由三段式可知,Vx =0.75 mol / L÷20min=0.0375 mol·(L·min)-1,对
C:10min时,乙容器中反应达到平衡,增大生成物的浓度,导致平衡向逆方向移动,对
D:由三段式的比较分析可得,甲、乙、丙的起始的物质的量之比都是2:1,构成等效平衡,由此可以判断X的转化率乙和丙是一样的,由此亦知Y的转化率没有发生变化,错
考查方向
解题思路
从图中可以看出,甲乙对比,乙达到平衡用时间比甲少,甲乙为进行单一变量实验
一组,其变量反应温度T1和T2可以判断出T2>T1 ,结合化学反应式和乙丙的对照实验,通过初始反
应物分压力和最终生成物浓度的比照,可以判断出本题所给选项对错
易错点
对平衡常数的理解不够,不能够从图中获取足够的信息,导致判断失误
知识点
9.冬日,雪花漫舞,给人带来美的享受,但降雪却会导致道路通行问题。现有一种高速公路 的绿色融雪剂-CMA(醋酸钙、醋酸镁固体的混合物,已知醋酸钙的溶解度随温度上升而下降,醋酸镁的溶解度随温度变化不大),其生产常以白云石(主要成分 MgCO3·CaCO3,含SiO2等杂质)和生物质废液——木醋液(主要成分乙酸,以及少量的
(1)步骤①发生的反应离子方程式为________________________________。
(2)滤渣1的主要成分与NaOH溶液反应的热化学方程式为________________________。
(己知l mol NaOH发生反应时放出热量为QkJ);步骤②所得滤液常呈褐色,分析可知其原因主要是木醋液中含有少量的有色的焦油以及____________。
(3)已知CMA中钙、镁的物质的量之比与出水率(与融雪 效果成正比)关系如图所示,步骤④的目的除调节 n(Ca):n(Mg) 约为____________(选填:A:1:3; B:1:2; C:3:7;D: 2:3)外,另一目的是____________。
(4)步骤⑥包含的操作有____________、过滤、洗涤及干燥。
(5)取akg含MgCO3
正确答案
(1)MgCO3·CaCO3+4CH3COOH=Ca2++Mg2++4CH3COO-+2CO2+2H2O
(2)SiO2(s)+2NaOH(aq)=Na2SiO3(aq)+H2O(l);△H=-2Q kJ/mol
实验过程中苯酚被空气中氧气氧化最终产生褐色物质
(3)C 除去过量的乙酸
(4)蒸发结晶
(5)
解析
根据流程图可知,白云石(主要成分MgCO3•CaCO3,含SiO2等杂质)与木醋液(主要成分乙酸)反应生成醋酸钙和醋酸镁,过滤得滤渣1为二氧化硅,滤液中主要溶质是醋酸钙和醋酸镁,加入活性碳脱色,再加入氧化镁,调节溶液中n(Ca):n(Mg)的值,过滤,除去混合液中固体杂质,得醋酸钙和醋酸镁溶液,将滤液蒸发结晶、过滤、洗涤及干燥得CMA,
(1)步骤①发生的反应离子方程式为 MgCO3•CaCO3+4CH3COOH=Ca2++Mg2++4CH3COO-+2CO2↑+2H2O,
故答案为:MgCO3•CaCO3+4CH3COOH=Ca2++Mg2++4CH3COO-+2CO2↑+2H2O;
(2)己知lmol NaOH与二氧化硅发生反应时放出热量为QkJ,则反应的热化学方程式为SiO2(s)+2NaOH(aq)=Na2SiO3(aq)+H2O(l),△H=-2QkJ/mol,
步骤②所得滤液常呈褐色,颜色除与木醋液中含有少量的有色的焦油有关外,产生颜色的另一主要原因是实验过程中苯酚被空气中氧气氧化最终产生褐色物质,
故答案为:SiO2(s)+2NaOH(aq)=Na2SiO3(aq)+H2O(l),△H=-2QkJ/mol;实验过程中苯酚被空气中氧气氧化最终产生褐色物质;
(3)根据如图2所示钙、镁的物质的量之比与出水率(与融雪效果成正比)关系,可知,当n(Ca):n(Mg)约为3:7时,出水率最高,所以步骤④的目的除调节n(Ca):n(Mg)约为3:7,步骤④中加入氧化镁的目的是调节钙、镁离子的物质的量之比,除去过量的乙酸,
故答案为:3:7;除去过量的乙酸;
(4)根据上面的分析可知,步骤⑥包含的操作有 蒸发结晶、过滤、洗涤及干燥,
故答案为:蒸发结晶;
(5)取akg含MgCO3•CaCO3质量分数为b%的白云石,经过上述流程制备CMA.已知MgCO3•CaCO3的损失率为c%,则可得
步骤④之后到产品CMA的损失率为d%,
则可知所得产品质量约为
考查方向
解题思路
根据流程图可知,白云石(主要成分MgCO3•CaCO3,含SiO2等杂质)与木醋液(主要成分乙酸)反应生成醋酸钙和醋酸镁,过滤得滤渣1为二氧化硅,滤液中主要溶质是醋酸钙和醋酸镁,加入活性碳脱色,再加入氧化镁,调节溶液中n(Ca):n(Mg)的值,过滤,除去混合液中固体杂质,得醋酸钙和醋酸镁溶液,将滤液蒸发结晶、过滤、洗涤及干燥得CMA,
(1)步骤①MgCO3•CaCO3与CH3COOH的反应生成醋酸钙和醋酸镁;
(2)己知lmol NaOH与二氧化硅发生反应时放出热量为QkJ,则反应的热化学方程式为SiO2(s)+2NaOH(aq)=Na2SiO3(aq)+H2O(l),△H=-2QkJ/mol,
步骤②所得滤液常呈褐色,颜色除与木醋液中含有少量的有色的焦油有关外,产生颜色的另一主要原因是实验过程中苯酚被空气中氧气氧化最终产生褐色物质;
(3)根据如图所示钙、镁的物质的量之比与出水率(与融雪效果成正比)关系,可知,当n(Ca):n(Mg)约为3:7时,出水率最高;
(4)根据上面的分析可知,步骤⑥包含的操作有 蒸发结晶、过滤、洗涤及干燥;
(5)取akg含MgCO3•CaCO3质量分数为b%的白云石,经过上述流程制备CMA.已知MgCO3•CaCO3的损失率为c%,则可得
步骤④之后到产品CMA的损失率为d%,以此计算产量.
易错点
需要学生具备扎实的基础知识与综合运用知识、信息进行解决问题的能力,(5)中计算易出错。
知识点
以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:
20.写出反应Ⅰ的化学方程式_________________________________。
21.生产中,向反应II中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是__________________。
22.下列有关说法正确的是__________________。
a.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
b.反应III中氧化剂与还原剂的物质的量之比为4︰1
c.反应IV需控制在60~70℃,目的之一是减少碳酸氢铵的分解
d.反应V中的副
23.反应Ⅴ在25℃、40%乙二醇溶液中进行,不断有硫酸钾晶体从溶液中析出,硫酸钾的产率会超过90%,选用40%乙二醇溶液的原因是__________________。
24.(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,写出二氧化氮与亚硫酸铵反应的化学方程式__________________。
正确答案
2CaCO3+2SO2+O2=2CaSO4+2
解析
碳酸钙、二氧化硫和氧气反应生成硫酸钙和二氧化碳,方程式为2CaCO3+2SO2+O2═2CaSO4+2CO2,故答案为:2CaCO3+2SO2+O2═2CaSO4+2CO2;
考查方向
解题思路
碳酸钙、二氧化硫和氧气反应生成硫酸钙和二氧化碳;
易错点
本题考查了物质的制备流程分析,反应产物判断,反应条件的选择和原因,仔细审读题意和流程是解题关键,题目难度中等。
正确答案
防止亚硫酸铵被氧化
解析
对苯二酚具有还原性,空气中的氧气具有氧化性,亚硫酸氨中+4价的硫具有还原性,故答案为:防止亚硫酸铵被氧化;
考查方向
解题思路
对苯二酚具有还原性,空气中的氧气具有氧化性,亚硫酸氨中+4价的硫具有还原性;
易错点
本题考查了物质的制备流程分析,反应产物判断,反应条件的选择和原因,仔细审读题意和流程是解题关键,题目难度中等。
正确答案
acd
解析
a.过量的空气把亚硫酸钙氧化为硫酸钙,故a正确;
b.反应Ⅲ化学方程式为:CaSO4+4C=CaS+4CO↑,氧化剂为CaSO4,还原剂为C,氧化剂与还原剂物质的量之比为1:4,故b错误;
c.防止碳酸氢铵在温度过高时分解得不到需要的目标产物,故c正确;
d、氯化铵含N元素,是一种氮肥,故d正确;
故答案为:acd;
考查方向
解题思路
a.过量的空气把亚硫酸钙氧化为硫酸钙;
b.反应Ⅲ化学方程式为:CaSO4+4C=CaS+4CO↑,氧化剂为CaSO4,还原剂为C,氧化剂与还原剂物质的量之比为1:4;
c.防止碳酸氢铵在温度过高时分解得不到需要的目标产物;
d、氯化铵含N元素,是一种氮肥;
易错点
本题考查了物质的制备流程分析,反应产物判断,反应条件的选择和原因,仔细审读题意和流程是解题关键,题目难度中等。
正确答案
K2SO4在40%的乙二醇溶液中溶解度小,能充分析出
解析
反应V中选用了40%的乙二醇溶液,温度控制在25℃,此时硫酸钾的产率超过90%,选用40%的乙二醇溶液原因是利用乙二醇降低硫酸钾溶解度,有利于析出,
故答案为:乙二醇是有机溶剂能减小K2SO4的溶解度,使硫酸钾充分析出;
考查方向
解题思路
反应V中选用了40%的乙二醇溶液,温度控制在25℃,此时硫酸钾的产率超过90%,选用40%的乙二醇溶液原因是利用乙二醇降低硫酸钾溶解度,有利于析出;
易错点
本题考查了物质的制备流程分析,反应产物判断,反应条件的选择和原因,仔细审读题意和流程是解题关键,题目难度中等。
正确答案
4(NH4)2SO3+2NO2=4(NH4)2SO4+N2
解析
(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统,二氧化氮与亚硫酸铵反应,二氧化氮具有强氧化性能氧化亚硫酸铵反应,生成硫酸铵,本身被还原为氮气,由原子守恒可知化学方程式为4(NH4)2SO3+2NO2=4(NH4)2SO4+N2,
故答案为:4(NH4)2SO3+2NO2=4(NH4)2SO4+N2。
考查方向
解题思路
(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统,二氧化氮与亚硫酸铵反应,二氧化氮具有强氧化性能氧化亚硫酸铵反应,生成硫酸铵,本身被还原为氮气。
易错点
本题考查了物质的制备流程分析,反应产物判断,反应条件的选择和原因,仔细审读题意和流程是解题关键,题目难度中等。
2. 下列有关实验的描述不正确的是( )
正确答案
解析
A选项钠与氯气发生反应生成氯化钠,为白色固体,火焰呈黄色,颜色不同,故A正确;
B选项氯水中含有次氯酸,分解生成氧气,硝酸不稳定,分解生成二氧化氮和氧气,故B正确;
C选项次氯酸和过氧化钠都具有强氧化性,可使品红褪色,原理相同,故C错误;
D选项SiO2属于酸性氧化物能用强碱NaOH反应,SiO2+2NaOH=Na2SiO3+2H2O, 故D正确。
考查方向
解题思路
①钠与氯气发生反应生成氯化钠,为白色固体,火焰呈黄色。
②氯水中含有次氯酸,分解生成氧气,硝酸不稳定,分解生成二氧化氮和氧气。
③次氯酸和过氧化钠都具有强氧化性。
④SiO2酸性氧化物能用强碱反应。
易错点
对钠和氯气及其化合物性质了解不全面。
知识点
扫码查看完整答案与解析