- 氮族元素简介
- 共57题
3. 镓(Ga)与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化合物。工业制备镓的流程如下图所示:
下列判断不合理的是
正确答案
解析
A.镓(Ga)与铝同主族,均处于ⅢA族,故A正确;
B.Ga2O3与Al2O3的性质具有相似性,可与盐酸反应生成GaCl3,故B正确;
C.Ga(OH)3属于两性氢氧化物,与Al(OH)3的性质相似,能与NaOH溶液生成NaGaO2,故C正确
D.化学反应遵循强酸制弱酸的原理,在NaAlO2和NaGaO2的混合液中通入CO2,只有Al(OH)3沉淀,而没有Ga(OH)3沉淀,可能是镓酸酸性强于碳酸,酸性Al(OH)3<Ga(OH)3,故D错误
考查方向
元素周期律与元素周期表
解题思路
A.镓(Ga)与铝同主族,均处于ⅢA族;
B.Ga2O3与Al2O3的性质具有相似性;
C.Ga(OH)3属于两性氢氧化物,与NaOH溶液生成NaGaO2;
D.由流程图可知,在NaAlO2和NaGaO2的混合液中通入CO2,只有Al(OH)3沉淀,而没有Ga(OH)3沉淀,化学反应遵循强酸制弱酸的原理
易错点
D项:强酸制弱酸原理
教师点评
本题是一道信息迁移题,考查金属铝以及化合物的性质,关键是对题目信息的理解与应用,注意理解同主族、同周期元素性质的相似性与递变性
知识点
A(C2H4)是基本的有机化工原料。用A和常见的有机物可合成一种醚类香料和一种缩醛类香料。具体合成路线如图所示(部分反应条件略去):
已知以下信息:
①
②D为单取代芳香族化合物且能与金属钠反应;每个D分子中只含有1个氧原子,D中氧元素的质量分数约为13.1%。
回答下列问题:
39.A的名称是 ,图中缩醛的分子式是 。
40.B的结构简式为 ,C中含有的官能团名称是 。
41.⑥的反应类型是 。
42.⑤的化学方程式为 。
43.请写出满足下列条件的苯乙醛的所有同分异构体的结构简式:含有苯环和
44.参照

正确答案
乙烯;C10H12O2。
解析
由分子式可知A为CH2=CH2,名称为乙烯,根据缩醛的结构简式,可知其分子式为:C10H12O2
考查方向
有机物的分子式、名称
解题思路
由分子式可知A为CH2=CH2,根据缩醛的结构简式确定其分子式
易错点
分子式
教师点评
本题考查有机物分子式、名称,在近几年的各省高考题中出现的频率较高,题目难度不大
正确答案
CH3OH;羟基。
解析
反应③符合信息①可知B为醇类,由其反应产物可推知B为甲醇,C为乙二醇,故B的结构简式为CH3OH,C中的官能团名称为羟基
考查方向
有机物的推断与合成、结构简式、官能团名称
解题思路
反应③符合信息①可知B为醇类,由其反应产物可推知B为甲醇,C为乙二醇,由此解答
易错点
官能团的名称
教师点评
本题考查有机物的推断与合成、结构简式、官能团名称,在近几年的各省高考题中出现的频率较高,题目难度不大
正确答案
氧化反应
解析
反应⑥是苯乙醇氧化生成苯乙醛,属于氧化反应
考查方向
有机反应类型
解题思路
反应⑥是苯乙醇氧化生成苯乙醛
易错点
根据官能团的变化准确判断有机反应类型
教师点评
本题考查有机反应类型,在近几年的各省高考题中出现的频率较高,题目难度不大
正确答案
解析
根据信息②可知D中含有苯环和羟基,设其分子式为CnH2n-6O,据D中氧元素的质量分数约为13.1%,得到

考查方向
有机反应方程式
解题思路
根据信息②可知D中含有苯环和羟基,据D中氧元素的质量分数约为13.1%反应可得到D的分子式为C8H10O,结合反应⑥可得到D的结构为
易错点
D的结构的推断
教师点评
本题考查有机物的推断与合成、有机反应方程式,,在近几年的各省高考题中出现的频率较高,题目难度不大
正确答案

解析
苯乙醛的同分异构体的满足:含有苯环和 结构,核磁共振氢谱有4组峰,峰面积之比为3:2:2:1,符合条件的同分异构体为
考查方向
同分异构体
解题思路
苯乙醛的同分异构体的满足:含有苯环和 结构,核磁共振氢谱有4组峰,峰面积之比为3:2:2:1,符合条件的同分异构体为
易错点
同分异构体中氢原子个数符合3:2:2:1
教师点评
本题考查有机物的推断与合成、同分异构体,在近几年的各省高考题中出现的频率非常高,题目难度较大
正确答案
解析
2-氯丙烷在氢氧化钠醇溶加热条件下发生消去反应生成CH2=CHCH3,在Ag作催化剂条件下氧化生成

考查方向
有机合成
解题思路
2-氯丙烷在氢氧化钠醇溶加热条件下发生消去反应生成CH2=CHCH3,在Ag作催化剂条件下氧化生成

易错点
官能团的转化及反应条件
教师点评
本题考查有机物的推断与合成,在近几年的各省高考题中出现的频率较高,题目难度较大
5. 生物材料衍生物2,5-呋喃二甲酸(
酸,与乙二醇合成材料聚2,5-呋喃二甲酸乙二醇酯(PEF)。下列说法正确的是
正确答案
解析
A.2,5-呋喃二甲酸和乙二醇发生反应时除了生成PEF外还生成水,属于缩聚反应,故A错误;
B.PEF中含有碳碳双键,能和氢气在一定条件下发生加成反应,故B错误;
C.聚对苯二甲酸乙二醇酯是由对苯二甲酸和乙二醇发生缩聚反应生成的酯,其结构简式为 
D.红外光谱获得分子中含有何种化学键或官能团的信息,质谱仪能记录分子离子、碎片离子的相对质量,故D错误
考查方向
有机物的结构和性质
解题思路
A.2,5-呋喃二甲酸和乙二醇发生反应时除了生成PEF外还生成水;
B.碳碳双键能和氢气在一定条件下发生加成反应;
C.聚对苯二甲酸乙二醇酯是由对苯二甲酸和乙二醇发生缩聚反应生成的酯;
D.红外光谱获得分子中含有何种化学键或官能团的信息
易错点
D项:红外光谱获得分子中含有何种化学键或官能团的信息,质谱仪能记录分子离子、碎片离子的相对质量
教师点评
本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,涉及反应类型判断、结构简式的书写
知识点
( )不属于行为规范。
A.品德规范
B.仪态仪表规范
C.劳动纪律
D.员工业务规范
正确答案
D
解析
[解析] 制度规范中的行为规范包括的内容有个人行为品德规范、劳动纪律、仪态仪表规范等。
一种以黄铁矿(主要含FeS2)为原料制备磁性纳米四氧化三铁的工艺流程如下,
其中缎烧后的烧渣含有(Fe2O3,、SiO2、FeO),回答下列问题:
19.缎烧时的主要方程式为
(填“氧化”或“还原”);当有lmolSO2生成时,转移的电子数为 mol。
20.尾气中的SO2对环境有污染,一种电化学治污的装置如右图,通SO2一侧的电极反应式为
21.酸溶时需保持盐酸过量,其目的是
22.若不能产生新的杂质,在调节比例前检测发现n (Fe2+)/ n(Fe3+)偏高,则加入的A是 〔填化学式),若比例偏低,加入的A是 (填化学式)。
23.写出沉淀发生的离子反应方程:
24.沉淀步骤中维持n(Fe2+)/ n(Fe3+)比例和控制一定的条件对得到高纯度的纳米级磁性F3O4非常关键,根据Fe2+、Fe3+的性质和下边提供的数据,在实际生产中需要采取的措施是
正确答案
【答案】略
正确答案
略
正确答案
略
正确答案
略
正确答案
略
正确答案
略
9.关于明矾的叙述正确的是
正确答案
解析
A、明矾是硫酸铝钾晶体,化学式是KAl(SO4)2●12H2O是一化合物,是一种纯净物;在水中会发生电离,KAl(SO4)2●12H2O=K+ +Al3++2SO42-+12H2O,A错;
B、Al3+在水中会发生水解生成Al(OH)3胶体,不是沉淀,所以B错误;
C、Al(OH)3胶体的表面积比较大,所以具有吸附性,可以吸附一些杂质。不是因为具有强氧化性,所以不具有杀菌、消毒的作用;
D、Fe3+也可以发生水解生成Fe(OH)3胶体。所以硫酸铁可以代替明矾,答案正确。
考查方向
本题考查明矾中Al3+的水解
解题思路
明矾是硫酸铝钾晶体,化学式是KAl(SO4)2●12H2O是一化合物,是一种纯净物;在水中会发生电离,KAl(SO4)2●12H2O=K+ +Al3++2SO42-+12H2O;Al3+在水中会发生水解生成Al(OH)3胶体,Al(OH)3胶体的表面积比较大,所以具有吸附性,可以吸附一些杂质。Fe3+也可以发生水解生成Fe(OH)3胶体。
易错点
Al3+水解程度较弱,不能生成沉淀;明矾净水原理是胶体表面积比较大吸附性,不具有杀菌消毒的作用。
教师点评
此题比较基础,考查的是明矾物质的名称和作用,其水溶液的Al3+水解;胶体的性质。
知识点
【化学——化学与技术】(15分)(选做题)
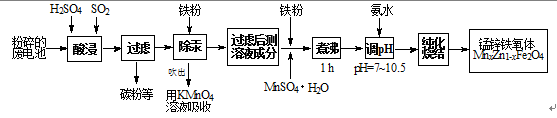
锰锌铁氧体是应用广泛的高性能磁性材料。现以a kg废旧碱性锌锰电池为原料(含锰元素的物质:MnO2占b %,MnOOH占c %)制备锰锌铁氧体,主要流程如下:
21.酸浸废电池时,SO2的作用是 (填字母编号)。
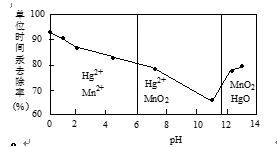
22.除汞是以氮气为载体吹入滤液带出汞蒸汽,经KMnO4溶液吸收而实现的。右图是KMnO4溶液处于不同pH时对应的单位时间Hg去除率变化图,图中物质为Hg与MnO-4在该pH范围反应的主要产物。
① pH<6时反应的离子方程式为___________。
② 汞的去除速率随pH变化的规律是_________。
23.锌锰干电池中MnO2可以用碳酸锰在空气中煅烧制得。
已知25℃,101 kPa时:2MnO(s)+O2(g)==2MnO2(s) ∆H=-272.0 kJ/mol
MnCO3(s)==MnO(s)+CO2(g) ∆H=+116.6 kJ/mol
碳酸锰在空气中煅烧反应生成MnO2的热化学方程式是 。
(4)x=0.2的锰锌铁氧体具有较高的饱和磁场强度,该锰锌铁氧体的组成用氧化物形式(最简整数比)表示为 。若制得这种锰锌铁氧体的质量为100 kg,在制取过程中不考虑损耗,需补充硫酸锰晶体(MnSO4·H2O) kg。(只列出计算式)
正确答案
考查方向
本题考查了氧化还原反应的应用
解题思路
从工艺流程最后可看出,锰元素的化合价为+3价,但废旧电池中分别为+3、+4,推出SO2 的作用是做还原剂。
教师点评
本小题考查了氧化还原反应的应用,在高考中氧化还原反应是难点也是热点,出现频率高。
正确答案
① 2MnO4-+5Hg+16H+==2Mn2++5Hg2++8H2O(3分)
②随pH增大,汞的去除速率先减小后增大(1分)
考查方向
根据条件写陌生离子方程式和图表分析能力
解题思路
第一空:根据题目所限制的条件,找到pH<6(酸性条件)是锰的元素和汞元素的存在形式再书写离子方程式。
第二空:看图像分析曲线的变化趋势。
易错点
书写离子方程式忽视酸性条件
教师点评
本题考查了离子方程式的书写和信息提取的能力,在高考中出现频率高。
正确答案
2MnCO3(s)+O2(g)==2MnO2(s)+2CO2(g) ∆H=-38.8 kJ/mol(3分)
考查方向
热化学方程式书写和盖斯定律
解题思路
2MnO(s)+O2(g)=2MnO2(s) ∆H1=-272.0 kJ/mol
MnCO3(s)=MnO(s)+CO2(g) ∆H2=+116.6 kJ/mol
2MnCO3(s)+O2(g)=2MnO2(s)+2CO2(g) ∆H=∆H1+2∆H2
教师点评
本题考查了热化学方程式的书写及盖斯定律,是高考中出现评论高。
正确答案
MnO·4ZnO·5Fe2O3(2分) 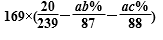
解析
x=0.2时,Mn0.2Zn0.8Fe2O4
100Kg Mn0.2Zn0.8Fe2O4 : n(Mn2+) =0.2x100kg/239g.mol-1
MnO2占b %,MnOOH占c %,即已经含有的 n(Mn2+)=ab%/87g.mol-1+ac%/88g.mol-1
需要补充的n(Mn2+)=0.2x100kg/239g.mol-1-ab%/87g.mol-1+ac%/88g.mol-1
m(MnSO4)=169x(0.2x100kg/239g.mol-1-ab%/87g.mol-1+ac%/88g.mol-1)
解题思路
第一空:x=0.2时,Mn0.2Zn0.8Fe2O4
同时扩大5倍:MnZn4Fe10O20
改写成氧化物形式:MnO·4ZnO·5Fe2O3
第二空:见解析
教师点评
本题考察了复盐的氧化物表示形式,在高考中出现较少。同事考查了简单的与物质的量有关的计算,在高考中出现频率中等。
扫码查看完整答案与解析