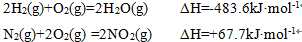- 氮气的化学性质
- 共19题
18. 氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用下图表示。
(1)海洋中的氮循环起始于氮的固定,其中属于固氮作用的一步是__________(填图中数字序号)。
(2)下列关于海洋氮循环的说法正确的是_________(填字母序号)。
a. 海洋中存在游离态的氮
b. 海洋中的氮循环起始于氮的氧化
c. 海洋中的反硝化作用一定有氧气的参与
d. 向海洋排放含NO3-的废水会影响海洋中NH4+的含量
(3)有氧时,在硝化细菌作用下,NH4+可实现过程④的转化,将过程④的离子方程式补充完整:
NH4+ + 5O2 === 2NO2- + H+ +_________+_________
(4)有人研究了温度对海洋硝化细菌去除氨氮效果的影响,下表为对10 L人工海水样本的监测数据:
硝化细菌去除氨氮的最佳反应温度是_________,在最佳反应温度时,48 h内去除氨氮
反应的平均速率是_________mg·L-1·h-1。
(5)为了避免含氮废水对海洋氮循环系统的影响,需经处理后排放。下图是间接氧化工业废水中氨氮(NH4+)的示意图。
① 结合电极反应式简述间接氧化法去除氨氮的原理:_________________。
② 若生成H2和N2的物质的量之比为3:1,则处理后废水的pH
将_________(填“增大”、“不变”或“减小”),请简述理由:__________________。
正确答案
(1)②
(2) ad
(3)4NH4+ + 5O2 === 2NO2- + 6H+ + N2O + 5H2O
(4)25℃ 1.125
(5)① 阳极反应Cl- -2e- = Cl2 产生的Cl2氧化废水中的NH4+释放出N2
② 减小,理由:电路中通过相同电量时,若生成n (H2):n (N2)=3:1,则阳极产生的H+比阴极消耗的H+多。
解析
(1)由图中信息可以看出海洋中的氮循环中属于固氮作用的一步是将N2转化为NH4+的过程,所以是图中的序号②;
(2)同样由图中信息可以看出海洋中存在游离态的氮,所以a正确;且由于向海洋排放含NO3-的废水会反硝化生成N2,而N2可以转化为NH4+,进而影响海洋中NH4+的含量,d正确;海洋中的氮循环起始于N2转化为NH4+的过程,这个过程是氮的还原过程,b错误,海洋中的反硝化作用一定是发生了氧化反应,但是不一定有氧气的参与,c错误;
(3)5个O2反应要转移20个电子,而2NH4+ 转化为2NO2- 转移12个电子,所以还有8个电子则一定有2个 N2O生成,再根据电荷守恒和原子守恒配平并补充H+,即离子方程式为:4NH4+ + 5O2 === 2NO2- + 6H+ + N2O + 5H2O ;
(4)由图中信息可以看出25℃时硝化细菌去除氨氮时氨氮含量最低,所以硝化细菌去除氨氮的最佳反应温度是25℃;在25℃时,48 h内去除氨氮反应的质量为=1008-468=540mg,所以反应速率=[540mg÷(10L)]÷48h=1.125mg·L-1·h-1;
(5)①由图中信息可以看出阳极有Cl2产生,所以阳极的电极反应为:Cl- -2e- = Cl2 ,而废水中的NH4+具有还原性,可以被Cl2氧化N2释放出;
②当电路中通过相同电量时,生成n (H2):n (N2)=3:1,则阳极产生的H+比阴极消耗的H+多,所以溶液中H+浓度增大,则溶液的pH减小;
考查方向
以氮元素在海洋中的循环为载体,考查有关图表信息、氮的固定、离子型氧化还原反应方程式的配平、实验条件的控制、反应速率的计算、电化学原理的应用和计算等。
解题思路
(1)由图中信息可以看出海洋中的氮循环中属于固氮作用的一步是将N2转化为NH4+的过程;
(2)同样由图中信息可以看出海洋氮循环的说法正确的是_______(填字母序号)。
a.海洋中存在游离态的氮
b.海洋中的氮循环起始于氮的氧化
c.海洋中的反硝化作用一定有氧气的参与
d.向海洋排放含NO3-的废水会影响海洋中NH4+的含量
(3)4NH4+ + 5O2 === 2NO2- + 6H+ + N2O + 5H2O
(4)25℃ 1.125
(5)① 阳极反应Cl- -2e- = Cl2 产生的Cl2氧化废水中的NH4+释放出N2
② 减小,理由:电路中通过相同电量时,若生成n (H2):n (N2)=3:1,则阳极产生的H+比阴极消耗的H+多。
易错点
不能准确观察和整合题给信息;配平方程式时不能有效使用电荷守恒进行配平;不能根据电子守恒分析电极反应中H+的变化,进而分析pH 的变化。
知识点
14.向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)

正确答案
解析
A.从图中可以看出,随反应进行反应物浓度减小,而正反应速率增大,说明体系温度升高,故正反应是放热反应,所以A正确;B.因为随反应进行反应物浓度减小,故反应物浓度:a点大于b点,b点大于c点,即a>b>c,所以B错误;C.反应在c点,反应速率仍在变化,说明反应仍在进行,故未达到平衡状态,所以C错误;D.在恒温恒容容器中,热量可以散失,所以平衡后容器的温度低于绝热恒容密闭容器中的温度,则在恒温恒容容器中反应进行程度大,SO2的转化率大,所以D错误。
考查方向
解题思路
A.因为随反应进行反应物浓度减小,而正反应速率增大,说明体系温度升高,故正反应是放热反应;B.因为随反应进行反应物浓度减小,故反应物浓度:a点大于b点,b点大于c点;C.反应在c点,反应速率仍在变化,说明反应仍在进行,故未达到平衡状态,D.若在恒温恒容容器中,以相同的投料进行该反应,平衡后容器的温度低于绝热恒容密闭容器中的温度,则在恒温恒容容器中反应进行程度大,SO2的转化率大。
易错点
绝热恒容密闭容器中的温度随着反应的进行要发生变化。
知识点
6.下列关于氮的固定的说法错误的是
正确答案
解析
氮的固定是将游离态的氮转化成化合态的氮,因此必然发生氧化还原反应,自然界的固氮可以转化成氮的氧化物或铵态氮,因此氮元素的化合价在固定过程中极可能别氧化也可能被还原。故选择C
考查方向
解题思路
准确把握氮的固定概念
易错点
概念认知错误
知识点
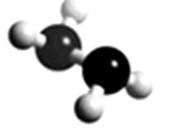
8.肼(N2H4)常用作火箭燃料,其分子的球棍模型如下图所示。肼能与H2O2发生反应:N2H4+2H2O2===N2+4H2O。设NA为阿伏加德罗常数的值,下列说法正确的是
正确答案
解析
A.32g N2H4的物质的量为1mol,含有共价键的总数为5NA,A错误;
B.标准状况下,过氧化氢为液态,不能用气体摩尔体积计算,B错误;
C.28g N2的物质的量为1mol,含电子总数为14NA,C错误;
D.17g H2O2所含非极性键数目为0.5NA,0.5mol N2H4的非极性键数目为0.5NA,D正确。
故选D。
考查方向
解题思路
A.32g N2H4的物质的量为1mol,含有共价键的总数为5NA;
B.标准状况下,过氧化氢为液态,不能用气体摩尔体积计算;
C.28g N2的物质的量为1mol,含电子总数为14NA;
D.17g H2O2所含非极性键数目为0.5NA,0.5mol N2H4的非极性键数目为0.5NA。
易错点
本题考查了阿伏伽德罗常数的应用,主要有分子结构的掌握,气体摩尔体积的计算应用等,题目难度中等。
知识点
NO能引起光化学烟雾,破坏臭氧层。处理NO有多种方法,请根据题意回答下列问题:
Ⅰ.利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:
2NO(g) + 2CO(g) 
为了测定某催化剂作用下的反应速率,在一定温度下,向某恒容密闭容器中充入等物质的量的NO和CO发生上述反应。用气体传感器测得不同时间NO浓度如表:
Ⅱ.臭氧也可用于处理NO。
15.前2s内的平均反应速率υ(N2)=______(保留3位有效数字,下同);计算此温度下该反应的K=____________。
16.达到平衡时,下列措施能提高NO转化率的是______。(填字母序号)
17.已知N2(g) + O2(g) =2NO(g) ΔH= +180 kJ/mol;则CO的燃烧热为_________。
18.O3氧化NO结合水洗可产生HNO3和O2,每生成1mol的HNO3转移________mol电子。
19.O3可由电解稀硫酸制得,原理如右图。图中阴极为_______(填“A”或“B”),阳极(惰性电极)的电极反应式为________________________。
正确答案
(1).2.08×10- 4 mol/(L•s) 3.65×106
解析
(1).前2s内的平均反应速率v(NO)=8.3×10- 4/2s=4.15×10- 4mol/(L•s),化学反应速率之比等于计量系数之比,因此v(N2)=2.08×10- 4 mol/(L•s) ;
该温度下,各物质的平衡浓度为:c(NO)=1.00×10- 4 mol·L-1;c(CO)=1.00×10- 4 mol·L-1;c(CO2)=9.00×10- 4 mol·L-1;c(N2)=4.50×10- 4 mol·L-1;此温度下该反应的
考查方向
解题思路
(1).前2s内的平均反应速率v(NO)=8.3×10- 4/2s=4.15×10- 4mol/(L•s),化学反应速率之比等于计量系数之比;
该温度下,根据各物质的平衡浓度求出反应的平衡常数;
易错点
本题综合考查了反应速率、反应方向、化学平衡等知识,并注重考查了学生对实验化学的设计思路,充分体现了新课程变化,同时又注重了对高考热点的考查,本题难度中等。
正确答案
解析
(2).2NO(g) + 2CO(g) 
故选BD;
考查方向
解题思路
(2).前2s内的平均反应速率v(NO)=8.3×10- 4/2s=4.15×10- 4mol/(L•s),化学反应速率之比等于计量系数之比;
该温度下,根据各物质的平衡浓度求出反应的平衡常数;
易错点
本题综合考查了反应速率、反应方向、化学平衡等知识,并注重考查了学生对实验化学的设计思路,充分体现了新课程变化,同时又注重了对高考热点的考查,本题难度中等。
正确答案
(3).284 kJ/mol或△H=-284kJ/mol
解析
(3).
根据盖斯定律:①+②得:
考查方向
解题思路
(3).根据盖斯定律求出CO的燃烧热;
易错点
本题综合考查了反应速率、反应方向、化学平衡等知识,并注重考查了学生对实验化学的设计思路,充分体现了新课程变化,同时又注重了对高考热点的考查,本题难度中等。
正确答案
(4).3
解析
(4).O3氧化NO结合水洗可产生HNO3和O2,化学方程式为:3O3+2NO+H2O=2HNO3+3O2,每生成2mol的HNO3转移6mol电子,每生成1mol的HNO3转移3mol电子;
考查方向
解题思路
(4).O3氧化NO结合水洗可产生HNO3和O2,根据氧化还原反应得失电子数判断;;
易错点
本题综合考查了反应速率、反应方向、化学平衡等知识,并注重考查了学生对实验化学的设计思路,充分体现了新课程变化,同时又注重了对高考热点的考查,本题难度中等。
正确答案
(5). B , 3H2O -6e-= O3 +6 H+
解析
(5).O3可由电解稀硫酸制得,原理如图,氢离子得电子生成氢气,阴极为B,阳极(惰性电极)水失去电子生成臭氧,电极反应式为3H2O -6e-= O3 +6 H+。
考查方向
解题思路
(5).氢离子得电子生成氢气,阴极为B,阳极(惰性电极)水失去电子生成臭氧。
易错点
本题综合考查了反应速率、反应方向、化学平衡等知识,并注重考查了学生对实验化学的设计思路,充分体现了新课程变化,同时又注重了对高考热点的考查,本题难度中等。
9.下列表示对应化学反应的离子方程式正确的是( )
正确答案
解析
A.NO2通入水中离子方程式为:3NO2+H2O═2H++2NO3-+NO,故A正确;
B.用两个铜电极电解CuSO4溶液,阳极铜失电子生成铜离子,阴极氢离子得到电子生成氢气,反应的化学方程式:Cu+2H2O
C.SO2通入FeCl3溶液中:SO2+2Fe3++2H2O═SO42-+2Fe2++4H+,故C错误;
D.过量的CO2通入NaAlO2溶液中生成氢氧化铝和碳酸氢钠:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故D错误;
故选A。
考查方向
解题思路
A.NO2通入水中离子方程式为:3NO2+H2O═2H++2NO3-+NO;
B.用两个铜电极电解CuSO4溶液,阳极铜失电子生成铜离子,阴极氢离子得到电子生成氢气,反应的化学方程式:Cu+2H2O
C.SO2通入FeCl3溶液中:SO2+2Fe3++2H2O═SO42-+2Fe2++4H+;
D.过量的CO2通入NaAlO2溶液中生成氢氧化铝和碳酸氢钠:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;
易错点
本题考查了离子方程式正误判断,明确物质的性质是解本题关键,再结合氧化还原反应、物质的溶解性、溶液的酸碱性等知识点来解答,易错选项是D,要考虑过量的CO2,为易错点。
知识点
6.氮的化合物可以通过电化学转化,右图为NO转化为NO2的工作原理示意图,下列说法正确的是( )
正确答案
解析
A.Pt电极上是O2发生反应,而在原电池中O2是氧化剂做正极,发生反应的还原反应,所以A错误;
B.由于是固体电解质,所以在电极反应中没有水参与反应,又图中信息可以看出是O2- 参与电极反应,所以电极反应为O2 + 4e- = 2O2-,所以B错误;
C.由于没有标准状况;所以无法计算O2的体积,所以C错误;
D.外电路中NiO电极为负极,电子由负极向正极移动,所以D正确。
考查方向
解题思路
A.Pt电极上是O2发生的是还原反应
B.固体电解质中是O2- 参与电极反应
C.没有标准状况,无法确定O2的体积为;
D.外电路中NiO电极为负极,电子由负极向正极移动
易错点
不能准确进行原电池电极反应的书写和判断、忽略气体体积计算中的标准状况;不能熟练判断电子、电流、离子的移动方向。
知识点
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
18.已知:N2(g)+O2(g) = 2NO(g) △H=+180.5kJ/mol
N2(g)+3H2(g) 
2H2(g)+O2(g) = 2H2O(g) △H=-483.6kJ/mol
若有17 g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为 .
19.某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g)
实验结果如图所示:
(图中T表示温度,n表示物质的量)
①图像中T2和T1的关系是:T2 T1(填“高于”、“低于”、“等于”“无法确定”)
②比较在a、b、c三点所处的平衡状态中,反应物N2 的转化率最高的是 (填字母).
③在起始体系中加入N2的物质的量为 mol时,反应后氨的百分含量最大; 若容器容积为1L,n=3mol反应达到平衡时H2的转化率为60%,则此条件下(T2), 反应的平衡常数K= .
20.N2O5是一种新型硝化剂,其性质和制备受到人们的关注
①一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g)
则500s内NO2的平均生成速率为 .
②现以H2、O2、熔融盐Na2CO3组成的燃料电池,
写出石墨I电极上发生反应的电极反应式 .
在电解池中生成N2O5的电极反应式为 .
正确答案
226.3 kJ
解析
N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol ①
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol ②
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol ③
由盖斯定律①×2-②×2+③×3得:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=905.2kJ/mol;
则17g 即1mol氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为1/4×905.2kJ=226.3 kJ,
故答案为:226.3 kJ;
考查方向
解题思路
根据盖斯定律来求反应的焓变,然后根据反应放出的热量与物质的量成正比;
①根据温度升高化学平衡向着吸热方向进行;
②根据增加氢气的物质的量化学平衡向着正反应方向移动;
③根据a、b、c三点所表示的意义来回答;
④根据反应物的物质的量之比为等于化学计量数之比时,达平衡状态时生成物的百分含量最大;根据化学平衡状态是反应物的转化率最大、生成物的产率最大来回答;先求出各自的平衡浓度,然后根据平衡常数的概念来回答;
⑤根据该反应为放热反应,温度升高,平衡向吸热的方向移动,平衡逆向移动,平衡常数减少;
易错点
1、根据温度升高化学平衡向着吸热方向进行
2、根据反应物的物质的量之比为等于化学计量数之比时,达平衡状态时生成物的百分含量最大。
正确答案
① 低于 ② c ③ n/3 ; 2.08
解析
①反应为放热反应,温度升高化学平衡向着吸热方向进行,从T1到T2反应物氮气的量增加,故T1<T2,故答案为:低于;
②b点代表平衡状态,c点又加入了氢气,故平衡向右移动,氮气的转化率增大,故答案为:c;
③当氮气和氢气的物质的量之比为1:3时达平衡状态时氨的百分含量最大,平衡点时产物的产率最大,据图示,当平衡时氢气的物质的量为n,故加入N2的物质的量为n/3,当n=3mol反应达到平衡时H2的转化率为60%,故起始氮气浓度为1,mol/l,变化的氢气浓度为1.8mol/l,变化的氮气浓度为0.6mol/l,平衡时氮气、氢气、氨气的浓度分别是0.4mol/l、1.2mol/l、1.2mol/l,据K==
考查方向
本题主要考查了热化学方程式;化学平衡建立的过程;化学平衡的调控作用。
解题思路
根据盖斯定律来求反应的焓变,然后根据反应放出的热量与物质的量成正比;
①根据温度升高化学平衡向着吸热方向进行;
②根据增加氢气的物质的量化学平衡向着正反应方向移动;
③根据a、b、c三点所表示的意义来回答;
④根据反应物的物质的量之比为等于化学计量数之比时,达平衡状态时生成物的百分含量最大;根据化学平衡状态是反应物的转化率最大、生成物的产率最大来回答;先求出各自的平衡浓度,然后根据平衡常数的概念来回答;
⑤根据该反应为放热反应,温度升高,平衡向吸热的方向移动,平衡逆向移动,平衡常数减少;
易错点
1、根据温度升高化学平衡向着吸热方向进行
2、根据反应物的物质的量之比为等于化学计量数之比时,达平衡状态时生成物的百分含量最大。
正确答案
①0.00592 mol•L-1•s-1
② H2 + CO32--2e- = CO2 + H2O
阳极:N2O4 + 2HNO3 - 2e— = 2N2O5 + 2H+
解析
①500s,c(N2O5)变化量为5.00-3.52=1.48mol/L,则v(N2O5)=1.48mol/L /500s=0.00296mol·L-1·s-1,由速率之比等于化学计量数之比可知,v(NO2)=0.00296mol·L-1·s-1×2=0.00592 mol·L-1·s-1;
②氢氧燃料电池中,氢气做负极,发生失电子成为氢离子的反应,在熔融碳酸盐碳酸钠的作用下,电极反应为:H2 + CO32--2e- = CO2 + H2O;电 解 池 中阳极为与氧气连接的电极,则阳极的反应为N2O4失去电子生成N2O5,电解质为无水硝酸,则电极反应式为N2O4 + 2HNO3 - 2e— = 2N2O5 + 2H+,故答案为① 0.00592 mol•L-1•s-1 ;② H2 + CO32--2e- = CO2 + H2O ;阳极:N2O4 + 2HNO3 - 2e—= 2N2O5+2H+。
考查方向
解题思路
根据盖斯定律来求反应的焓变,然后根据反应放出的热量与物质的量成正比;
①根据温度升高化学平衡向着吸热方向进行;
②根据增加氢气的物质的量化学平衡向着正反应方向移动;
③根据a、b、c三点所表示的意义来回答;
④根据反应物的物质的量之比为等于化学计量数之比时,达平衡状态时生成物的百分含量最大;根据化学平衡状态是反应物的转化率最大、生成物的产率最大来回答;先求出各自的平衡浓度,然后根据平衡常数的概念来回答;
⑤根据该反应为放热反应,温度升高,平衡向吸热的方向移动,平衡逆向移动,平衡常数减少;
易错点
1、根据温度升高化学平衡向着吸热方向进行
2、根据反应物的物质的量之比为等于化学计量数之比时,达平衡状态时生成物的百分含量最大。
氮氧化物是造成雾霾天气的主要原因之一。消除氮氧化物有多种方法。
25.硝酸厂常用催化还原法处理尾气:催化剂存在时用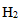
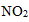
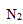
已知:
则H2还原NO2生成水蒸气反应的热化学方程式是 。
26.NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。发生的化学反应是2NH3(g)+NO(g)+NO2(g) 
27.利用ClO2氧化氮氧化物反应过程如下:NO 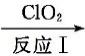
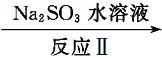
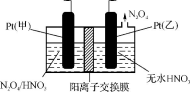
28.工业废气中含有的NO2还可用电解法消除。用NO2为原料可制新型绿色硝化剂N2O5。制备方法之一是先将NO2转化为N2O4,然后采用电解法制备N2O5,如图。Pt(甲)为 极,电解池中生成N2O5的电极反应式是 。
正确答案
1;4H2(g)+2NO2(g)=N2(g)+4H2O(g) ΔH=-1034.9kJ·mol-1
解析
①2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ·mol-1,
②N2(g)+2O2(g) =2NO2(g) ΔH=+67.7kJ·mol-1,
由①×2-②得:4H2(g)+2NO2(g)=N2(g)+4H2O(g) ΔH=-483.6kJ·mol-1×2-67.7kJ·mol-1=-1034.9kJ·mol-1,
故答案为:4H2(g)+2NO2(g)=N2(g)+4H2O(g) ΔH=-1034.9kJ·mol-1;
考查方向
氮的氧化物的性质及其对环境的影响;用盖斯定律进行有关反应热的计算;电解原理。
解题思路
根据盖斯定律来写热化学方程式;
易错点
本题涉及热化学方程式、化学平衡移动、化学计算、电解原理等知识点,题目难度较高。
正确答案
增大NH3浓度(或减小压强、降低温度)
解析
增大NH3浓度、减小压强、降低温度平衡正向移动,氮氧化物的转化率增大,故答案为:增大NH3浓度(或减小压强、降低温度);
考查方向
氮的氧化物的性质及其对环境的影响;用盖斯定律进行有关反应热的计算;电解原理。
解题思路
根据增大NH3浓度、增大压强、降低温度平衡正向移动,氮氧化物的转化率增大;
易错点
本题涉及热化学方程式、化学平衡移动、化学计算、电解原理等知识点,题目难度较高。
正确答案
2NO2+4Na2SO3=N2+4Na2SO4 67.5
解析
二氧化氮具有氧化性,能氧化Na2SO3生成Na2SO4,本身被还原成氮气,方程式为2NO2+4Na2SO3═N2+4Na2SO4,故答案为:2NO2+4Na2SO3═N2+4Na2SO4;由2NO+ClO2+H2O═NO2+HNO3+2HCl,2NO2+4Na2SO3═N2+4Na2SO4得: 2ClO2 ~N2 135g 22.4L67.5g 11.2L所以共消耗ClO267.5g,故答案为:67.5;
考查方向
氮的氧化物的性质及其对环境的影响;用盖斯定律进行有关反应热的计算;电解原理。
解题思路
根据二氧化氮具有氧化性,能氧化Na2SO3生成Na2SO4,本身被还原成氮气;通过化学方程式建立关系式然后计算;
易错点
本题涉及热化学方程式、化学平衡移动、化学计算、电解原理等知识点,题目难度较高。
正确答案
阳极 N2O4+2HNO3-2e-=2N2O5+2H+
解析
从电解原理来看,N2O4制备N2O5为氧化反应,则N2O5应在阳极区生成,反应式为N2O4+2HNO3-2e-=2N2O5+2H+,故答案为:阳;N2O4+2HNO3-2e-=2N2O5+2H+。
考查方向
解题思路
由N2O4制取N2O5需要是去电子,所以N2O5在阳极区生成。
易错点
本题涉及热化学方程式、化学平衡移动、化学计算、电解原理等知识点,题目难度较高。
在铜的催化作用下氨气与氟气反应,得到一种三角锥形分子M和一种铵盐N。下列有关说法错误的是()
正确答案
解析
略
知识点
扫码查看完整答案与解析