- 氮族元素简介
- 共57题
9.关于明矾的叙述正确的是
正确答案
解析
A、明矾是硫酸铝钾晶体,化学式是KAl(SO4)2●12H2O是一化合物,是一种纯净物;在水中会发生电离,KAl(SO4)2●12H2O=K+ +Al3++2SO42-+12H2O,A错;
B、Al3+在水中会发生水解生成Al(OH)3胶体,不是沉淀,所以B错误;
C、Al(OH)3胶体的表面积比较大,所以具有吸附性,可以吸附一些杂质。不是因为具有强氧化性,所以不具有杀菌、消毒的作用;
D、Fe3+也可以发生水解生成Fe(OH)3胶体。所以硫酸铁可以代替明矾,答案正确。
考查方向
本题考查明矾中Al3+的水解
解题思路
明矾是硫酸铝钾晶体,化学式是KAl(SO4)2●12H2O是一化合物,是一种纯净物;在水中会发生电离,KAl(SO4)2●12H2O=K+ +Al3++2SO42-+12H2O;Al3+在水中会发生水解生成Al(OH)3胶体,Al(OH)3胶体的表面积比较大,所以具有吸附性,可以吸附一些杂质。Fe3+也可以发生水解生成Fe(OH)3胶体。
易错点
Al3+水解程度较弱,不能生成沉淀;明矾净水原理是胶体表面积比较大吸附性,不具有杀菌消毒的作用。
教师点评
此题比较基础,考查的是明矾物质的名称和作用,其水溶液的Al3+水解;胶体的性质。
知识点
【化学——化学与技术】(15分)(选做题)
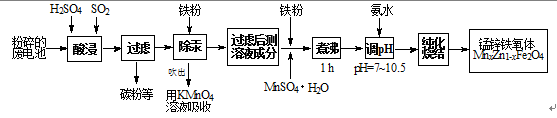
锰锌铁氧体是应用广泛的高性能磁性材料。现以a kg废旧碱性锌锰电池为原料(含锰元素的物质:MnO2占b %,MnOOH占c %)制备锰锌铁氧体,主要流程如下:
21.酸浸废电池时,SO2的作用是 (填字母编号)。
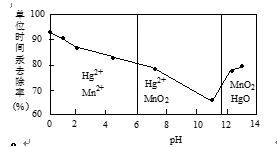
22.除汞是以氮气为载体吹入滤液带出汞蒸汽,经KMnO4溶液吸收而实现的。右图是KMnO4溶液处于不同pH时对应的单位时间Hg去除率变化图,图中物质为Hg与MnO-4在该pH范围反应的主要产物。
① pH<6时反应的离子方程式为___________。
② 汞的去除速率随pH变化的规律是_________。
23.锌锰干电池中MnO2可以用碳酸锰在空气中煅烧制得。
已知25℃,101 kPa时:2MnO(s)+O2(g)==2MnO2(s) ∆H=-272.0 kJ/mol
MnCO3(s)==MnO(s)+CO2(g) ∆H=+116.6 kJ/mol
碳酸锰在空气中煅烧反应生成MnO2的热化学方程式是 。
(4)x=0.2的锰锌铁氧体具有较高的饱和磁场强度,该锰锌铁氧体的组成用氧化物形式(最简整数比)表示为 。若制得这种锰锌铁氧体的质量为100 kg,在制取过程中不考虑损耗,需补充硫酸锰晶体(MnSO4·H2O) kg。(只列出计算式)
正确答案
考查方向
本题考查了氧化还原反应的应用
解题思路
从工艺流程最后可看出,锰元素的化合价为+3价,但废旧电池中分别为+3、+4,推出SO2 的作用是做还原剂。
教师点评
本小题考查了氧化还原反应的应用,在高考中氧化还原反应是难点也是热点,出现频率高。
正确答案
① 2MnO4-+5Hg+16H+==2Mn2++5Hg2++8H2O(3分)
②随pH增大,汞的去除速率先减小后增大(1分)
考查方向
根据条件写陌生离子方程式和图表分析能力
解题思路
第一空:根据题目所限制的条件,找到pH<6(酸性条件)是锰的元素和汞元素的存在形式再书写离子方程式。
第二空:看图像分析曲线的变化趋势。
易错点
书写离子方程式忽视酸性条件
教师点评
本题考查了离子方程式的书写和信息提取的能力,在高考中出现频率高。
正确答案
2MnCO3(s)+O2(g)==2MnO2(s)+2CO2(g) ∆H=-38.8 kJ/mol(3分)
考查方向
热化学方程式书写和盖斯定律
解题思路
2MnO(s)+O2(g)=2MnO2(s) ∆H1=-272.0 kJ/mol
MnCO3(s)=MnO(s)+CO2(g) ∆H2=+116.6 kJ/mol
2MnCO3(s)+O2(g)=2MnO2(s)+2CO2(g) ∆H=∆H1+2∆H2
教师点评
本题考查了热化学方程式的书写及盖斯定律,是高考中出现评论高。
正确答案
MnO·4ZnO·5Fe2O3(2分) 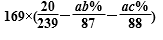
解析
x=0.2时,Mn0.2Zn0.8Fe2O4
100Kg Mn0.2Zn0.8Fe2O4 : n(Mn2+) =0.2x100kg/239g.mol-1
MnO2占b %,MnOOH占c %,即已经含有的 n(Mn2+)=ab%/87g.mol-1+ac%/88g.mol-1
需要补充的n(Mn2+)=0.2x100kg/239g.mol-1-ab%/87g.mol-1+ac%/88g.mol-1
m(MnSO4)=169x(0.2x100kg/239g.mol-1-ab%/87g.mol-1+ac%/88g.mol-1)
解题思路
第一空:x=0.2时,Mn0.2Zn0.8Fe2O4
同时扩大5倍:MnZn4Fe10O20
改写成氧化物形式:MnO·4ZnO·5Fe2O3
第二空:见解析
教师点评
本题考察了复盐的氧化物表示形式,在高考中出现较少。同事考查了简单的与物质的量有关的计算,在高考中出现频率中等。
扫码查看完整答案与解析