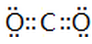- 海水资源及其综合利用
- 共118题
( )被称为企业的“宪法”。
A.企业管理制度
B.企业基本制度
C.企业薪酬制度
D.企业培训制度
正确答案
B
解析
[解析] 企业基本制度是企业的“宪法”,是企业制度规范中带有根本性质的、规定企业形成和组织方式、决定企业性质的基本制度。
多晶硅是太阳能光伏产业的基础材料。制备多晶硅必须先得到高纯硅。三氯甲硅烷(SiHCl3)是一种可燃,易与水反应的气体,当前制备高纯硅的主要方法是在一定条件下以三氯甲硅烷为原料用氢气还原,其生产流程如下图所示
17.① 流化床反应器中主要反应的化学方程式是 ,
在生成的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和 。② 整个制备过程中必须保证无水无氧。SiHCl3遇H2O剧烈反应生
成H2SiO3、HCl和另一种物质,写出该反应的化学方程式: 。③ H2还
原SiHCl3过程中若混入O2,可能引起的后果是 。
18.该工艺流程可循环利用的物质是 。
19.Na2SiO3的水溶液俗称水玻璃,用水玻璃可制得高纯度SiO2。取少量水玻璃于试管中,逐滴加入饱
和NH4Cl溶液,振荡。观察到的实验现象是 。
20.电弧炉中制得的粗硅中含有副产物SiC,已知其中Si和SiC的物质的量之比为2∶1,
制取粗硅时的化学方程式是 ,
若在反应中生成了2.8 g Si,则转移电子数为 。
正确答案
① Si+3HCl
精馏(或蒸馏)。 (1分)② SiHCl3+3H2O===H2SiO3↓+3HCl↑+H2↑ (2分。反应式写
对即给1分。)③O2与SiHCl3、H2混合可能引起爆炸(2分)。
解析
①流化床反应器中Si和HCl反应生成SiHCl3和氢气,反应的化学方程式为Si+3HCl
②SiHCl3遇H2O剧烈反应生成H2SiO3、HCl和另一种物质为H2,反应的化学方程式为SiHCl3+3H2O═H2SiO3↓+3HCl↑+H2↑
③H2、SiHCl3是一种可燃性气体,所以若混入O2,加热后会引起爆炸
考查方向
本题考查物质的制备、分离和提纯
解题思路
①流化床反应器中Si和HCl反应生成SiHCl3和氢气;根据SiHCl3、SiCl4、SiH2Cl2、SiH3Cl的沸点可知,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和精馏;
②SiHCl3遇H2O剧烈反应生成H2SiO3、HCl和另一种物质为H2,根据元素守恒可写出反应的化学方程式;
③H2、SiHCl3是一种可燃性气体,所以若混入O2,加热后会引起爆炸
易错点
SiH3Cl、SiH2Cl2、SiHCl3、SiCl4混合物中SiHCl3的提纯,利用题目所给沸点信息考虑分离方法
教师点评
本题考查物质的制备、分离和提纯,在近几年的高考题中出现的频率较高,常以新型材料的制备为出题点,重点考查实验基本操作
正确答案
H2和HCl (2分。只填一个正确给1分,填错或多填0分)
解析
石英砂和焦炭高温加热反应生成粗硅和一氧化碳,粗硅在流化床反应器中和HCl反应生成SiHCl3和氢气,氢气在后面可以循环利用,在还原炉中被氢气还原生成高纯硅,同时生成HCl可循环利用
考查方向
本题考查工艺流程原理分析
解题思路
石英砂和焦炭高温加热反应生成粗硅和一氧化碳,粗硅在流化床反应器中和HCl反应生成SiHCl3和氢气,氢气在后面可以循环利用,在还原炉中被氢气还原生成高纯硅,同时生成HCl可循环利用
易错点
实验原理及基本操作的分析
教师点评
本题考查工艺流程原理分析,在近几年的高考题中出现的频率较高,多以新型材料的合成或是其某种合成原材料为出题点,题目难度中等
正确答案
试管中有白色胶状沉淀生成(1分),有刺激性气味气体生成(1分)
解析
由于 氯化铵溶液水解呈酸性,所以Na2SiO3的水溶液中加入饱和NH4Cl溶液会生成硅酸沉淀,同时有氨气生成,所以反应的现象为试管中有白色胶状沉淀生成,有刺激性气味气体生成
考查方向
本题主要考查实验现象描述
解题思路
由于氯化铵溶液水解呈酸性,所以Na2SiO3的水溶液中加入饱和NH4Cl溶液会生成硅酸沉淀
易错点
反应原理分析,注意水解、电离等相关内容
教师点评
本题主要考查实验现象描述,在近几年的各省高考题中出现的频率较高,对于反应原理的分析是解题的关键
正确答案
3SiO2+7C===2Si+SiC+6CO↑ (2分,产物写对,但配平错误得1分。写成两个化学方程式不给分。) 。0.6 NA或3.612×1023 (2分 写0.6 mol 不得分)
解析
电弧炉中用碳还原二氧化硅生Si和SiC的物质的量之比为2:1,反应的化学方程式为3SiO2+7C═2Si+SiC+6CO↑,反应中电子转移数目为12,所以当有2.8g Si即0.1molSi生成时,转移电子数为0.6 NA或3.612×1023
考查方向
本题主要考查化学方程式及其计算
解题思路
电弧炉中用碳还原二氧化硅生Si和SiC的物质的量之比为2:1,根据元素守恒和电荷守恒书写化学方程式,根据反应中电子转移数目可计算出2.8g Si转移电子数
易错点
氧化还原反应中电子转移的分析,找准发生变价的元素
教师点评
本题主要考查化学方程式及其计算,在近几年的各省高考题中出现的频率较高,常与氧化还原反应等知识交汇命题
6.在恒容密闭容器中通入X并发生反应:2X(g) 
正确答案
解析
由图可知,温度为T1先到达平衡,所以T1>T2,温度越高,平衡时X的物质的量浓度越大,说明升高温度平衡向逆反应移动,升高温度平衡向吸热反应移动,故逆反应为吸热反应,正反应为放热反应,
A、温度越高反应速率越大,已知T1>T2,则N点的逆反应速率V逆小于M点的正反应速率V正,故A错误;
B、T2下,在0~t1时间内,X的浓度变化为:c(X)=(a-b)mol/L,则Y的浓度变化为

C、M点时再加入一定量X,达到的新平衡与原平衡比较,压强增大,增大压强平衡正移,则X的转化率增大,所以M点时再加入一定量X,平衡后X的转化率增大,故C错误;
D、进行到M点X的转化率较低,由于正向是放热反应,所以反应进行到M点放出的热量少,故D正确;
考查方向
本题考查了化学平衡图象问题、平衡有关计算、外界条件对平衡移动影响等知识点
解题思路
由图可知,温度为T1先到达平衡,所以T1>T2,温度越高,平衡时X的物质的量浓度越大,说明升高温度平衡向逆反应移动,升高温度平衡向吸热反应移动,故逆反应为吸热反应,正反应为放热反应,
A、温度越高反应速率越大;
B、根据图中X的浓度变化求出Y的浓度变化,再求反应速率;
C、M点时再加入一定量X,达到的新平衡与原平衡比较,根据压强对平衡的影响分析;
D、根据图象判断参加反应的X的量的多少,反应的X越多,放热越多
易错点
C项中转化率的分析
教师点评
本题考查了化学平衡图象问题、平衡有关计算、外界条件对平衡移动影响等知识点,在近几年的各省高考题中出现的频率非常高,常与反应速率、吸放热反应、转化率等知识点交汇命题
知识点
对于大体积混凝土,除应满足棍凝土强度要求外,还应考虑保温措施,拆模之后要保证混凝土内外温差不超过()℃,以免发生温差裂缝。
A.5
B.10
C.15
D.20
正确答案
D
解析
暂无解析
采购与仓库保管费不包括( )。
A.采购人员工资
B.装卸费
C.工资附加费
D.差旅交通费
正确答案
B
解析
采购与仓库保管费指采购、验收、保管和收发设备所发生的各种费用,包括设备采购人员、保管人员和管理人员的工资、工资附加费、办公费、差旅交通费,设备供应部门办公和仓库所,占固定资产使用费、工具用具使用费、劳动保护费、检验试验费等。这些费用可按主管部门规定的采购与保管费费率计算。
7. 某铵态氮肥由W、X、Y、Z等4种短周期元素组成,其中W的原子半径最小。
I.若Y、Z同主族,ZY2是形成酸雨的主要物质之一。
(1)Z元素的原子结构示意图是 ;X和Y的原子半径 
(2)X的最髙价氧化物对应水化物的稀溶液与铜反应的离子方程式为
。
(3)一定条件下,1 mol XW3气体与O2完全反应生成X元素的单质和液态水,放出 382.8 kJ热量。该反应的热化学方程式为 。
II.若Z是形成化合物种类最多的元素。
(4)该氮肥分解时会完全转化为气体,其中一种酸性气体的电子式为 。
(5)HR是含

①右图中x 7(填“>”、“<”或“=”)。
②a点时溶液中各种离子浓度由大到小的顺序是 。
正确答案
(1)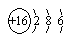

(2)3Cu + 8H+ + NO3-(稀) = 3Cu(NO3)2 + 2NO↑+ 4H2O(2分)
(3)NH3(g)+3/4O2(g)=1/2N2(g)+3/2H2O(l) △H=—382.8kJ•mol—1,(2分)
或4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H=—1531.2 kJ•mol—1(或其他合理答案)
(4) 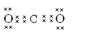
(5) > (2分) c(Na+)>c(R-)>c(OH-)>c(H+) (2分)
解析
某铵态氮肥由W、X、Y、Z等4种短周期元素组成,该铵盐中一定含有N、H元素,且W的原子半径最小,则W为H元素.
Ⅰ.若Y、Z同主族,ZY2是形成酸雨的主要物质之一,则ZY2为SO2,Y为O、Z为S元素,故X为N元素:
(1)S原子核外电子数为18,原子结构示意图为
(2)Cu与稀硝酸反应生成硝酸铜、NO与水,反应离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
(3)发生反应:4NH3+3O2═2N2+6H2O,4mol氨气反应放出的热量为382.8kJ×4=1531.2kJ,反应热化学方程式为:4NH3(g)+3O2(g)═2N2(g)+6H2O(l)△H=-1531.2 kJ•mol-1 ,
Ⅱ.若Z是形成化合物种类最多的元素,则Z为C元素:
(4)该氮肥为碳酸铵或碳酸氢铵,完全分解得到酸性气体为CO2,电子式为:
(5)①a点时两种物质恰好完全反应,则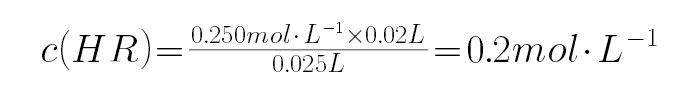
②溶液R-水解,溶液呈碱性,则c(Na+)>c(R-),水解程度微弱,溶液中离子浓度为:c(Na+)>c(R-)>c(OH-)>c(H+)
考查方向
本题考查元素推断、电子式、离子方程式书写、热化学方程式、盐类水解等知识
解题思路
某铵态氮肥由W、X、Y、Z等4种短周期元素组成,该铵盐中一定含有N、H元素,且W的原子半径最小,则W为H元素.
Ⅰ.若Y、Z同主族,ZY2是形成酸雨的主要物质之一,则ZY2为SO2,Y为O、Z为S元素,故X为N元素:
(1)S原子核外电子数为18,根据核外电子排布规律画出原子结构示意图;同周期自左而右原子半径减小;
(2)Cu与稀硝酸反应生成硝酸铜、NO与水;
(3)发生反应:4NH3+3O2═2N2+6H2O,计算4mol氨气反应放出的热量,注明物质聚集状态与反应热,书写热化学方程式;
Ⅱ.若Z是形成化合物种类最多的元素,则Z为C元素:
(4)该氮肥为碳酸铵或碳酸氢铵,完全分解得到酸性气体为CO2;
(5)a点时两种物质恰好完全反应,则
,而HR溶液的pH=3,则HR为弱酸,NaR为强碱弱酸盐,溶液呈碱性.
易错点
元素的推断及电子式
教师点评
本题考查元素推断、电子式、离子方程式书写、热化学方程式、盐类水解等知识,在近几年的各省高考题中出现的频率较非常高,试题知识点较多、综合性较强,题目难度中等
知识点
6.分子式为C5H10O2且能与NaHCO3反应放出气体的有机物有(不含立体异构)
正确答案
解析
分子式为C5H10O2且与NaHCO3能产生气体,则该有机物中含有-COOH,所以为饱和一元羧酸,烷基为-C4H9,
-C4H9异构体有:-CH2CH2CH2CH3,-CH(CH3)CH2CH3,-CH2CH(CH3)CH3,-C(CH3)3,故符合条件的有机物的异构体数目为4,
故选C.
考查方向
有机物的同分异构现象
解题思路
分子式为C5H10O2且与NaHCO3溶液能产生气体,则该有机物中含有-COOH,所以为饱和一元羧酸,烷基为-C4H9,丁基异构数等于该有机物的异构体数.
易错点
有机物官能团的性质、同分异构体的书写。
教师点评
本题主要考查同分异构体书写、官能团的性质与确定等,侧重于学生的分析能力的考查,难度中等,熟练掌握碳原子数小于5的烃基的个数是解决本题的关键,甲基与乙基均1种,丙基2种、丁基4种、戊基8种.
知识点
某兴趣小组为了探究铁粉与水蒸气反应的产物,做了下面实验。
资料:在不同温度下,铁粉与水蒸气反应的产物不同。
实验一:某兴趣小组用下图所示装置,使铁粉与过量水蒸气充分反应并检验固体产物的组成。
13.实验过程中,应先点燃 (选填“酒精灯”或“酒精喷灯”);目的是 ,装置中石棉绒的作用是 。
14.若在实验中的某段时间内生成H2 0.2g,则这段时间内参加反应的铁粉质量至少是 g。
15.实验二:铁粉完全反应后,兴趣小组对硬质玻璃管中生成的FeO和Fe3O4的质量进行测定,实验流程如下图。
1)实验前检查装置A的气密性:关闭止水夹K,从长颈漏斗向试管内加水,至长颈漏斗中管内的液面高于管外液面,静置一段时间,若液面高度差 ,则气密性良好。
2)装置A中发生的反应方程式 。
3)为了安全,在点燃酒精灯之前,在F装置出口b处必须 。
4)装置C中所放试剂为 ,装置B的作用是 。
5)干燥管E右边又连接干燥管F的目的是 。
若无干燥管F,测得Fe3O4的质量将 (填“偏大”、“偏小”或“无影响”)。
正确答案
酒精灯(1分)先产生水蒸气,排尽空气(2分)增大铁粉与水蒸气接触面积(1分)
考查方向
基本实验操作
解题思路
本题实验目的是研究铁与水蒸气的反应,实验前让水蒸气充满整个试管排走空气,所以先点燃酒精灯。铁粉是固体与水蒸气接触面积小,放在石棉绒上可以增大接触面积,使其充分反应。
教师点评
本题考察了基本的实验操作,比较简单,在高考中出现频率高。
正确答案
4.2
考查方向
根据化学方程式进行计算。
解题思路
56 2 168 8
x 0.2g y 0.2g
x=5.6g y=4.2g
在反应中两个反应都可能发生,所以铁粉的用量在4.2g-5.6g之间。 最小为4.2g
教师点评
本小题考察了根据化学方程式进行计算,不需用到高中知识,在高考中出现概率低。
正确答案
(1)不变(1分)
(2)Zn+2HCl=ZnCl2+H2↑(1分)
(3)验纯(1分)
(4)浓硫酸(1分)除去HCl气体(1分)
(5)防止空气中的二氧化碳和水被E吸收(1分)偏大(2分)
考查方向
实验题考察
解题思路
(1)气密性检查的方法
(2)略
(3)实验安全问题,氢气不纯加热可能发生爆炸
(4)氢气中含有水蒸气会使E出称量质量不准确,故要除去
(5)空气中也有水蒸气,加F可以防止其进入E,保证E收集的水蒸气全部由氢气还原生成的。
教师点评
本题是比较简单的实验考查题,考查的知识浅显易懂,高考出现如此简单大题的概率小。
扫码查看完整答案与解析