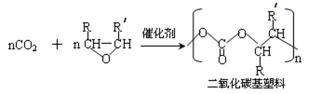
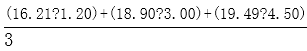- 海水资源及其综合利用
- 共118题
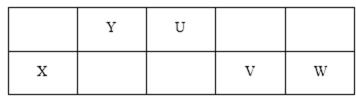
已知 X、Y、U、V、W、Z是六种常见元素,其中X、Y、U、V、W五种短周期元素在周期表中的位置如下图所示:
U的最简单气态氢化物能使湿润的红色石蕊试纸变蓝。Z是人体血红蛋白中存在的金属元素。请填写下列空白:
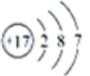
7. Z元素在周期表中的位置 W的原子结构示意图
8. X、U、V、W形成的简单离子半径由大到小的顺序为 (用离子符号表示)
9.用电子式表示Y的最高价氧化物的形成过程
10.X、W两元素的最高价氧化物对应水化物能相互反应,该反应的离子方程式为
11.Na2V的水溶液呈 性,用离子方程式解释其原因
其水溶液中离子浓度由大到小的顺序为
正确答案
第四周期 第Ⅷ族
解析
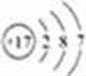
U的最简单气态氢化物能使湿润的红色石蕊试纸变蓝,该气体为氨气,则U为N元素;结合X、Y、U、V、W五种短周期元素在周期表中的位置可知,Y为C、X为Al、V为S、W为Cl元素;Z是人体血红蛋白中存在的金属元素,则Z为Fe元素,Z为Fe元素,其原子序数为26,位于周期表中第四周期 第Ⅷ族;W为Cl元素,其原子序数为17,则氯原子结构示意图为:
考查方向
解题思路
U的最简单气态氢化物能使湿润的红色石蕊试纸变蓝,该气体为氨气,则U为N元素;结合X、Y、U、V、W五种短周期元素在周期表中的位置可知,Y为C、X为Al、V为S、W为Cl元素;Z是人体血红蛋白中存在的金属元素,则Z为Fe元素。
易错点
推断元素,原子结构与元素周期表、元素周期表的关系。
正确答案
S2->Cl->N3->Al3+
解析
U的最简单气态氢化物能使湿润的红色石蕊试纸变蓝,该气体为氨气,则U为N元素;结合X、Y、U、V、W五种短周期元素在周期表中的位置可知,Y为C、X为Al、V为S、W为Cl元素;Z是人体血红蛋白中存在的金属元素,则Z为Fe元素,电子层越多,离子半径越大,电子层相同时核电荷数越大,离子半径越小,则X、U、V、W形成的简单离子半径由大到小的顺序为:S2﹣>Cl﹣>N3﹣>Al3+,故答案为:S2﹣>Cl﹣>N3﹣>Al3+;
(3)Y为C元素,用电子式表示Y的最高价氧化物二氧化碳的形成过程为: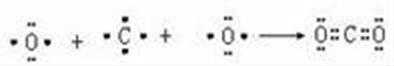
故答案为:
考查方向
解题思路
U的最简单气态氢化物能使湿润的红色石蕊试纸变蓝,该气体为氨气,则U为N元素;结合X、Y、U、V、W五种短周期元素在周期表中的位置可知,Y为C、X为Al、V为S、W为Cl元素;Z是人体血红蛋白中存在的金属元素,则Z为Fe元素。
易错点
推断元素,原子结构与元素周期表、元素周期表的关系。
正确答案
解析
U的最简单气态氢化物能使湿润的红色石蕊试纸变蓝,该气体为氨气,则U为N元素;结合X、Y、U、V、W五种短周期元素在周期表中的位置可知,Y为C、X为Al、V为S、W为Cl元素;Z是人体血红蛋白中存在的金属元素,则Z为Fe元素,Y为C元素,用电子式表示Y的最高价氧化物二氧化碳的形成过程为:
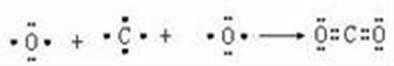
考查方向
解题思路
U的最简单气态氢化物能使湿润的红色石蕊试纸变蓝,该气体为氨气,则U为N元素;结合X、Y、U、V、W五种短周期元素在周期表中的位置可知,Y为C、X为Al、V为S、W为Cl元素;Z是人体血红蛋白中存在的金属元素,则Z为Fe元素。
易错点
推断元素,原子结构与元素周期表、元素周期表的关系。
正确答案
Al(OH)3 + 3H+ = Al3+ + 3H2O
解析
U的最简单气态氢化物能使湿润的红色石蕊试纸变蓝,该气体为氨气,则U为N元素;结合X、Y、U、V、W五种短周期元素在周期表中的位置可知,Y为C、X为Al、V为S、W为Cl元素;Z是人体血红蛋白中存在的金属元素,则Z为Fe元素,X、W两元素的最高价氧化物对应水化物分别为氢氧化铝和高氯酸,二者反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O,故答案为:Al(OH)3+3H+=Al3++3H2O;
考查方向
解题思路
U的最简单气态氢化物能使湿润的红色石蕊试纸变蓝,该气体为氨气,则U为N元素;结合X、Y、U、V、W五种短周期元素在周期表中的位置可知,Y为C、X为Al、V为S、W为Cl元素;Z是人体血红蛋白中存在的金属元素,则Z为Fe元素。
易错点
推断元素,原子结构与元素周期表、元素周期表的关系。
正确答案
【答案】碱性 S2-+H2O 
C(Na+)>C(S2-) >C(OH-)>C(HS-)>C(H+)
解析
U的最简单气态氢化物能使湿润的红色石蕊试纸变蓝,该气体为氨气,则U为N元素;结合X、Y、U、V、W五种短周期元素在周期表中的位置可知,Y为C、X为Al、V为S、W为Cl元素;Z是人体血红蛋白中存在的金属元素,则Z为Fe元素,Na2V为Na2S,硫离子在溶液中发生水解:S2﹣+H2O⇌HS﹣+OH﹣,导致溶液呈碱性,则c(OH﹣)>c(H+),氢氧根离子还来自水的电离,则c(OH﹣)>c(HS﹣)>c(H+),溶液中离子浓度大小为:c(Na+)>c(S2﹣)>c(OH﹣)>c(HS﹣)>c(H+),故答案为:碱性;S2﹣+H2O⇌HS﹣+OH﹣;c(Na+)>c(S2﹣)>c(OH﹣)>c(HS﹣)>c(H+).
考查方向
解题思路
U的最简单气态氢化物能使湿润的红色石蕊试纸变蓝,该气体为氨气,则U为N元素;结合X、Y、U、V、W五种短周期元素在周期表中的位置可知,Y为C、X为Al、V为S、W为Cl元素;Z是人体血红蛋白中存在的金属元素,则Z为Fe元素。
易错点
推断元素,原子结构与元素周期表、元素周期表的关系。
5.150℃时,在固定容积的密闭容器中将1 L气态混合烃与9 L氧气(足量)混合点燃,恢复到原温度时容器内压强为原来的108%,则原混合烃组成可能是
正确答案
解析
A:甲烷的燃烧方程式:CH4+2O2=CO2+2H2O,燃烧前后体积不变
乙烷的燃烧方程式:2C2H6+7O2=4CO2+6H2O,燃烧后体积比原来增加了1体积,由比例1:4可知,乙烷体积为0.8L,故由化学方程式乙烷系数知增加的体积为0.4,燃烧后体积增加了(1+9+0.4)/(1+9) ×100%=104%;错
B:乙烯燃烧方程式:C2H4+3O2=2CO2+2H2O,反应前后体积不变,丁烷燃烧方程式:2C4H10+13O2=8CO2+10H2O,反应后体积增加了3体积,乙烯:丁烷=4:1,丁烷体积为0.2L,由化学方程式丁烷系数知增加的体积为(0.2L/2) ×3=0.3L; 燃烧后体积增加了(1+9+0.3)/(1+9) ×100%=103%;错
C:丙炔燃烧方程式:C3H4+4O2=3CO2+2H2O,反应后体积不变;乙炔燃烧方程式:2C2H2+5O2=4CO2+2H2O,反映后体积减少了1体积,错
D:乙烯燃烧方程式:C2H4+3O2=2CO2+2H2O,反应前后体积不变,丁烯燃烧方程式:C4H8+6O2=4CO2+4H2O,反应后体积增加了1体积,而乙烯:丁烯=1:4,故丁烯体积为0.8L,由化学方程式丁烯系数知增加的体积为(0.8L/1) ×1=0.8L; 燃烧后体积增加了(1+9+0.8)/(1+9) ×100%=108%;对
考查方向
解题思路
由燃烧后恢复原温度的压强为原来的108%,得知燃烧后气体物质的量为原来的108%,由于温度为150℃,H2O呈现气态,通过燃烧方程式进行计算;可以理解为反应前后的体积是增大的,包括水的气体状态下的体积,按照所给的四个选项,一项一项的排除,写出正确的而化学反应方程式。
易错点
燃烧方程式的书写计算错误,及题目审题不仔细,在150℃时的产物的存在的状态判断失误,及题中所涉及的压强变为原来的108%所表示的含义。
知识点
用含有Al2O3及少量Fe3O4和SiO2的铝土矿制备净水剂——液体聚合硫酸铝铁,工艺流程如下(部分操作和条件略):
I.向铝土矿中加入过量H2SO4后,加热、搅拌、过滤。
II.向滤液中加入一定量的双氧水。
III.向溶液中加入Ca(OH)2固体,调节溶液的pH约为1,过滤。
IV.加入稳定
10. Fe3O4与H2SO4反应的离子方程式是___________。
11.步骤I中过滤时用到的玻璃仪器是____________,得到的滤渣成分是________(填化学式)。
12.步骤II中增大n(Fe3+)的离子方程式是_________。
13.铝土矿也可用于冶炼金属Al。以金属Al作阳极,稀硫酸作电解液,通过电解会使金属Al的表面生成致密坚硬的氧化膜,其电极反应式是_________。
正确答案
Fe3O4 + 8H+ = 2Fe3+ + Fe2+ + 4H2O;
解析
硫酸溶解四氧化三铁生成硫酸铁、硫酸亚铁和水,离子方程式:Fe3O4 + 8H+ = 2Fe3+ + Fe2+ + 4H2O;
考查方向
解题思路
硫酸溶解四氧化三铁生成硫酸铁、硫酸亚铁和水;
易错点
本题解题的关键是离子方程式的书写、电极方程式的书写,发现反应物和生成物有助于方程式的书写。
正确答案
普通漏斗、玻璃棒、烧杯 SiO2
解析
步骤I中过滤时用到的玻璃仪器是普通漏斗、玻璃棒、烧杯;Fe3O4 与硫酸反应生成铁离子、亚铁离子,Al2O3与硫酸反应生成铝离子,而SiO2不与硫酸发生反应,故过滤后的滤渣为SiO2;
考查方向
解题思路
步骤I中过滤时用到的玻璃仪器是普通漏斗、玻璃棒、烧杯;
Fe3O4 与硫酸反应生成铁离子、亚铁离子,Al2O3与硫酸反应生成铝离子,而SiO2不与硫酸发生反应;
易错点
本题解题的关键是离子方程式的书写、电极方程式的书写,发现反应物和生成物有助于方程式的书写。
正确答案
H2O2+2Fe2++2H+=2H2O+2Fe3+;
解析
FeSO4被双氧水在酸性溶液中氧化生成Fe3+,离子方程式是:H2O2+2Fe2++2H+=2H2O+2Fe3+;
考查方向
解题思路
FeSO4被双氧水在酸性溶液中氧化生成Fe3+;
易错点
本题解题的关键是离子方程式的书写、电极方程式的书写,发现反应物和生成物有助于方程式的书写。
正确答案
2Al-6e-+3H2O =Al2O3+6H+。
解析
以金属Al作阳极,稀硫酸作电解液,通过电解会使金属Al的表面生成致密坚硬的氧化膜,阳极Al失电子生成Al2O3,电极反应式2Al-6e-+3H2O =Al2O3+6H+。
考查方向
解题思路
(4).以金属Al作阳极,稀硫酸作电解液,通过电解会使金属Al的表面生成致密坚硬的氧化膜。
易错点
本题解题的关键是离子方程式的书写、电极方程式的书写,发现反应物和生成物有助于方程式的书写。
3.对于常温下pH=1的硝酸溶液,有关叙述: ()
① 该溶液1 mL稀释至100 mL后, pH=3
② 向该溶液中加入等体积、 pH=13的氢氧化钡溶液恰好完全中和
③ 该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为
④ 向该溶液中加入等体积、等浓度的氨水,所得溶液pH=7
其中正确的是
正确答案
解析
pH=1的硝酸溶液c(H+)=0.1mol/L,①据c=n/v计算;②pH=13的溶液c(OH-)=0.1mol/L;③根据Kw=c(H+)×c(OH-)=10-14计算;④氨水为弱电解质,不能完全电离,生成强酸弱碱盐.
考查方向
解题思路
pH=1的硝酸溶液c(H+)=0.1mol/L,①c=n/v=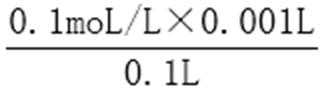
②pH=13的溶液c(OH-)=0.1mol/L,等体积混合恰好完全中和,故②正确;
③硝酸电离出的c(H+)=0.1mol/L,由Kw=c(H+)×c(OH-)=10-14可知,水电离出的c(H+)=10-13mol/L,该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为1012,故③错误;
④氨水为弱电解质,不能完全电离,生成强酸弱碱盐,反应后溶液呈酸性,故④错误.
易错点
酸碱混合时的定性判断及有关ph的计算。
知识点
3.下列有关电解质溶液中粒子浓度关系正确的是 ( )
正确答案
解析
A、根据电荷守恒,pH=1的NaHSO4溶液存在:c(Na+)+c(H+)=2c(SO42‾)+c(OH‾),因为c(Na+)=c(SO42‾),所以c(H+)=c(SO42‾)+c(OH‾),正确;
B、含有AgCl和AgI固体的悬浊液:c(Ag+)> c(Cl‾)>c(Br‾),错误;
C、H2CO3的第一步电离大于第二步电离,所以c(H+) > c(HCO3‾) >c(CO32‾),但c(HCO3‾)不等于c(CO32‾),错误;
D、NaHC2O4和Na2C2O4物质的量相等,根据物料守恒可得:3c(Na+)=2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)],正确。
考查方向
解题思路
A、电荷守恒c(Na+)+c(H+)=2c(SO42‾)+c(OH‾)
B、c(Ag+)> c(Cl‾)>c(Br‾);
C、H2CO3的第一步电离大于第二步电离;
D、NaHC2O4和Na2C2O4物质的量相等。
易错点
H2CO3的第一步电离大于第二步电离,电解质溶液中的守恒定律。
知识点
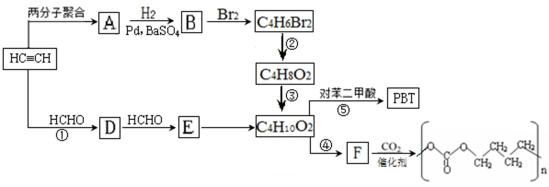
下列是两种途径生产工程塑料(PBT)和全降解二氧化碳基塑料的制备过程。
已知:
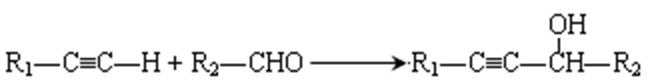
12.请写出A的结构简式 D的分子式
13.B的系统命名法的名称 E中官能团的名称为 
14.写出下列反应的反应类型:① ⑤
15.已知C4H6Br2是顺式结构,写出②的化学方程式
反应④的化学反应方程式
反应⑤的化学反应方程式
16.F的同分异构体有多种,写出满足下列条件的分子的结构简式
Ⅰ. 能发生银镜反应
Ⅱ.核磁共振氢谱显示有三个峰
正确答案
CH≡CCH=CH2 C3H4O
解析
乙炔与甲醛发生加成反应生成D为HC≡CCH2OH,D与甲醛进一步发生加成反应生成E为HOCH2C≡CCH2OH,E与氢气发生加成反应生成HOCH2CH2CH2CH2OH,2分子乙炔聚合得到A为HC≡CCH=CH2,结合信息可知及HOCH2CH2CH2CH2OH可知,A与氢气发生加成反应生成B为CH2=CHCH=CH2,B与溴发生加成反应生成BrCH2CH=CHCH2Br,BrCH2CH=CHCH2Br与氢气发生加成反应生成BrCH2CH2CH2CH2Br,BrCH2CH2CH2CH2Br发生水解反应得到HOCH2CH2CH2CH2OH,1,4﹣丁二醇与对苯二甲酸发生缩聚反应生成PBT为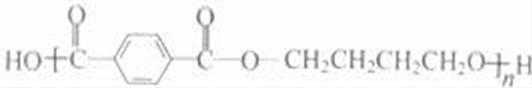

考查方向
解题思路
乙炔与甲醛发生加成反应生成D为HC≡CCH2OH,D与甲醛进一步发生加成反应生成E为HOCH2C≡CCH2OH,E与氢气发生加成反应生成HOCH2CH2CH2CH2OH,2分子乙炔聚合得到A为HC≡CCH=CH2,结合信息可知及HOCH2CH2CH2CH2OH可知,A与氢气发生加成反应生成B为CH2=CHCH=CH2,B与溴发生加成反应生成BrCH2CH=CHCH2Br,BrCH2CH=CHCH2Br与氢气发生加成反应生成BrCH2CH2CH2CH2Br,BrCH2CH2CH2CH2Br发生水解反应得到HOCH2CH2CH2CH2OH,1,4﹣丁二醇与对苯二甲酸发生缩聚反应生成PBT为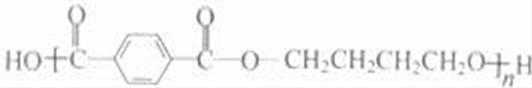

易错点
对给予的信息有机物分子式与结构进行利用进行推断。
正确答案
1,
解析
乙炔与甲醛发生加成反应生成D为HC≡CCH2OH,D与甲醛进一步发生加成反应生成E为HOCH2C≡CCH2OH,E与氢气发生加成反应生成HOCH2CH2CH2CH2OH,2分子乙炔聚合得到A为HC≡CCH=CH2,结合信息可知及HOCH2CH2CH2CH2OH可知,A与氢气发生加成反应生成B为CH2=CHCH=CH2,B与溴发生加成反应生成BrCH2CH=CHCH2Br,BrCH2CH=CHCH2Br与氢气发生加成反应生成BrCH2CH2CH2CH2Br,BrCH2CH2CH2CH2Br发生水解反应得到HOCH2CH2CH2CH2OH,1,4﹣丁二醇与对苯二甲酸发生缩聚反应生成PBT为

考查方向
解题思路
乙炔与甲醛发生加成反应生成D为HC≡CCH2OH,D与甲醛进一步发生加成反应生成E为HOCH2C≡CCH2OH,E与氢气发生加成反应生成HOCH2CH2CH2CH2OH,2分子乙炔聚合得到A为HC≡CCH=CH2,结合信息可知及HOCH2CH2CH2CH2OH可知,A与氢气发生加成反应生成B为CH2=CHCH=CH2,B与溴发生加成反应生成BrCH2CH=CHCH2Br,BrCH2CH=CHCH2Br与氢气发生加成反应生成BrCH2CH2CH2CH2Br,BrCH2CH2CH2CH2Br发生水解反应得到HOCH2CH2CH2CH2OH,1,4﹣丁二醇与对苯二甲酸发生缩聚反应生成PBT为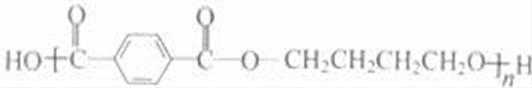

易错点
对给予的信息有机物分子式与结构进行利用进行推断。
正确答案
加成反应 缩聚反应
解析
乙炔与甲醛发生加成反应生成D为HC≡CCH2OH,D与甲醛进一步发生加成反应生成E为HOCH2C≡CCH2OH,E与氢气发生加成反应生成HOCH2CH2CH2CH2OH,2分子乙炔聚合得到A为HC≡CCH=CH2,结合信息可知及HOCH2CH2CH2CH2OH可知,A与氢气发生加成反应生成B为CH2=CHCH=CH2,B与溴发生加成反应生成BrCH2CH=CHCH2Br,BrCH2CH=CHCH2Br与氢气发生加成反应生成BrCH2CH2CH2CH2Br,BrCH2CH2CH2CH2Br发生水解反应得到HOCH2CH2CH2CH2OH,1,4﹣丁二醇与对苯二甲酸发生缩聚反应生成PBT为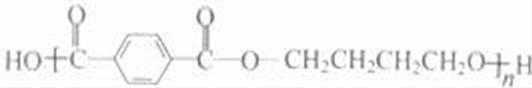

考查方向
解题思路
乙炔与甲醛发生加成反应生成D为HC≡CCH2OH,D与甲醛进一步发生加成反应生成E为HOCH2C≡CCH2OH,E与氢气发生加成反应生成HOCH2CH2CH2CH2OH,2分子乙炔聚合得到A为HC≡CCH=CH2,结合信息可知及HOCH2CH2CH2CH2OH可知,A与氢气发生加成反应生成B为CH2=CHCH=CH2,B与溴发生加成反应生成BrCH2CH=CHCH2Br,BrCH2CH=CHCH2Br与氢气发生加成反应生成BrCH2CH2CH2CH2Br,BrCH2CH2CH2CH2Br发生水解反应得到HOCH2CH2CH2CH2OH,1,4﹣丁二醇与对苯二甲酸发生缩聚反应生成PBT为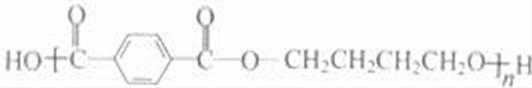

易错点
对给予的信息有机物分子式与结构进行利用进行推断。
正确答案

解析
乙炔与甲醛发生加成反应生成D为HC≡CCH2OH,D与甲醛进一步发生加成反应生成E为HOCH2C≡CCH2OH,E与氢气发生加成反应生成HOCH2CH2CH2CH2OH,2分子乙炔聚合得到A为HC≡CCH=CH2,结合信息可知及HOCH2CH2CH2CH2OH可知,A与氢气发生加成反应生成B为CH2=CHCH=CH2,B与溴发生加成反应生成BrCH2CH=CHCH2Br,BrCH2CH=CHCH2Br与氢气发生加成反应生成BrCH2CH2CH2CH2Br,BrCH2CH2CH2CH2Br发生水解反应得到HOCH2CH2CH2CH2OH,1,4﹣丁二醇与对苯二甲酸发生缩聚反应生成PBT为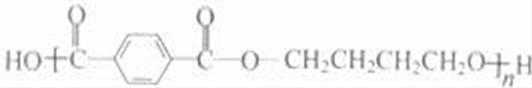

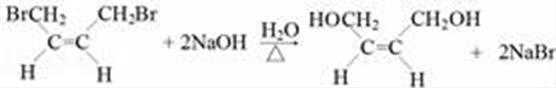


故答案为:


考查方向
解题思路
乙炔与甲醛发生加成反应生成D为HC≡CCH2OH,D与甲醛进一步发生加成反应生成E为HOCH2C≡CCH2OH,E与氢气发生加成反应生成HOCH2CH2CH2CH2OH,2分子乙炔聚合得到A为HC≡CCH=CH2,结合信息可知及HOCH2CH2CH2CH2OH可知,A与氢气发生加成反应生成B为CH2=CHCH=CH2,B与溴发生加成反应生成BrCH2CH=CHCH2Br,BrCH2CH=CHCH2Br与氢气发生加成反应生成BrCH2CH2CH2CH2Br,BrCH2CH2CH2CH2Br发生水解反应得到HOCH2CH2CH2CH2OH,1,4﹣丁二醇与对苯二甲酸发生缩聚反应生成PBT为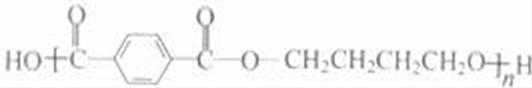

易错点
对给予的信息有机物分子式与结构进行利用进行推断。
正确答案
(CH3)2 CH CHO
解析
乙炔与甲醛发生加成反应生成D为HC≡CCH2OH,D与甲醛进一步发生加成反应生成E为HOCH2C≡CCH2OH,E与氢气发生加成反应生成HOCH2CH2CH2CH2OH,2分子乙炔聚合得到A为HC≡CCH=CH2,结合信息可知及HOCH2CH2CH2CH2OH可知,A与氢气发生加成反应生成B为CH2=CHCH=CH2,B与溴发生加成反应生成BrCH2CH=CHCH2Br,BrCH2CH=CHCH2Br与氢气发生加成反应生成BrCH2CH2CH2CH2Br,BrCH2CH2CH2CH2Br发生水解反应得到HOCH2CH2CH2CH2OH,1,4﹣丁二醇与对苯二甲酸发生缩聚反应生成PBT为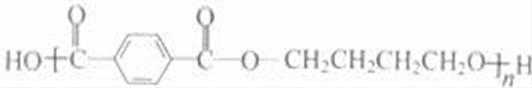


故答案为:(CH3)2 CH CHO.
考查方向
解题思路
乙炔与甲醛发生加成反应生成D为HC≡CCH2OH,D与甲醛进一步发生加成反应生成E为HOCH2C≡CCH2OH,E与氢气发生加成反应生成HOCH2CH2CH2CH2OH,2分子乙炔聚合得到A为HC≡CCH=CH2,结合信息可知及HOCH2CH2CH2CH2OH可知,A与氢气发生加成反应生成B为CH2=CHCH=CH2,B与溴发生加成反应生成BrCH2CH=CHCH2Br,BrCH2CH=CHCH2Br与氢气发生加成反应生成BrCH2CH2CH2CH2Br,BrCH2CH2CH2CH2Br发生水解反应得到HOCH2CH2CH2CH2OH,1,4﹣丁二醇与对苯二甲酸发生缩聚反应生成PBT为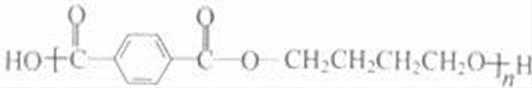

易错点
对给予的信息有机物分子式与结构进行利用进行推断。
10.下列说法正确的是( )
正确答案
解析
A选项按系统命名法为3,3,4-三甲基己烷,A错误;
B选项乙烯、乙炔是较活泼的有机物,能发生氧化反应,能使酸性高锰酸钾褪色及与O2燃烧反应,甲烷和苯性质较稳定,不能使酸性高锰酸钾褪,但能与O2燃烧反应,能发生氧化反应,B错误
C选项分子式为C
D选项解答本题时应注意,在回答“A、B应满足什么条件”的问题时不能只答“最简式相同”,因为“最简式相同”仅是题目要求找出的规律的特例,还不全面。因为题目只要求生成H2O的质量不变,至于其它元素究竟是C还是O,题目是不问的。如果将C换成O,只要仍然保持H的质量百分含量不变,也应当是符合题目要求的。根据C原子量为12、O原子量为16,可知,如果用4个C换3个O也应该是可行的。例如C12H8和C6H4符合题意,将后者6个C中的4个C换成3个O得到分子式为C2H4O3也应该符合条件,所以D错误。
本题正确答案是C
考查方向
解题思路
A选项按系统命名法为3,3,4-三甲基己烷,A错误;
B选项乙烯、乙炔是较活泼的有机物,能发生氧化反应,能使酸性高锰酸钾褪色及与O2燃烧反应,甲烷和苯性质较稳定,不能使酸性高锰酸钾褪,但能与O2燃烧反应,能发生氧化反应,B错误
C选项分子式为C
D选项解答本题时应注意,在回答“A、B应满足什么条件”的问题时不能只答“最简式相同”,因为“最简式相同”仅是题目要求找出的规律的特例,还不全面。因为题目只要求生成H2O的质量不变,至于其它元素究竟是C还是O,题目是不问的。如果将C换成O,只要仍然保持H的质量百分含量不变,也应当是符合题目要求的。根据C原子量为12、O原子量为16,可知,如果用4个C换3个O也应该是可行的。例如C12H8和C6H4符合题意,将后者6个C中的4个C换成3个O得到分子式为C2H4O3也应该符合条件,所以D错误。
B选项不正确,C选项不正确,D选项不正确,所有选A选项。
易错点
关键把握有机官能团的性质;有机物燃烧的规律
知识点
9.碳酸氢铵、硫酸铵均是我国主要的氮肥品种,碳酸氢铵在贮存和运输过程中容易挥发损失。为了鉴定其质量和确定田间施用量,必须测定其含氮量。
I.某学生欲测定碳酸氢铵化肥中的含氮量,选用下列装置通过测定生成二氧化碳的量间接测出化肥的含氮量。
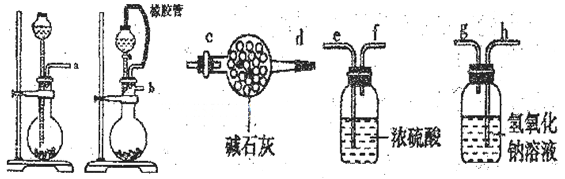
(1)请选择必要的装置(每个装置最多使用一次),按气流方向连接顺序为__________ 组装好装置,连在最后的装置起到的作用 。
(2) 检验气密性后,将样品放入圆底烧瓶中,滴加液体。该液体最适合的是_________________.
A.稀盐酸
B.稀硫酸
C.浓硝酸
D.氢氧化纳
II.如果氮肥中成分是硫酸铵,则可以用甲醛法测定含氮量,反应为:2(NH4)2SO4+6HCHO=(CH2)6N4+2H2SO4再将生成的酸用氢氧化钠标准溶液滴定,从而测出氮的含量。步骤如下:
(3)用差量法称取固体(NH4)2SO4样品0.6g于烧杯中,加蒸馏水溶解配成100mL溶液,准确量取20.00mL的待测液溶液于锥形瓶中,加入适量l8%的中性甲醛,放置5min后,加入1-2滴_______指示剂(已知滴定终点的pH约为8.8),用浓度为0.0800mol/L氢氧化钠标准溶液滴定至终点。再重复滴定2次,三次滴定的读数如下表:
计算出该样品中的氮的质量分数为_______________。
(4)在滴定实验结束后发现滴定用的碱式滴定管玻璃尖嘴内出现了气泡,滴定开始时无气泡,则此实验测定的含氮量比实际值________(填”偏大“偏小”或“无影响”)。
(5)如果测定碳酸氢铵化肥中的含氮量时,也使用甲醛法是否合理____________(填“是”或“否”),理由是 。
正确答案
(1)b-e-f-h-g-c
防止空气中的水蒸气和CO2进入前面装置影响实验结果
(2)B
(3)酚酞 14%
(4)偏小
(5) 否,因为用甲醛法制的碳酸不稳定,不适合中和滴定
解析
(1)根据反应装置--干燥装置--吸收装置-尾气处理装置排序,所以其排列顺序是:b-e,f-h,g-c,故答案为:b-e,f-h,g-c;
(2)制取二氧化碳时需要碳酸盐和酸反应,稀盐酸、浓硝酸都具有挥发性,影响实验结果,氢氧化钠和盐不能生成二氧化碳,故选B;
(3)硫酸铵属于强酸弱碱盐,其溶液呈酸性,所以需要酸式滴定管量取硫酸铵溶液,滴定终点的pH约为8.8,酚酞的变色范围是8-10,所以选取酚酞作指示剂;滴定终点时,溶液从无色变为浅红色,30s内不褪色;
2(NH4)2SO4+6HCHO=(CH2)6N4+2H2SO4+6H2O、2NaOH+H2SO4=Na2SO4+2H2O,所以硫酸铵和NaOH的关系式为:(NH4)2SO4---2NaOH,NaOH溶液的平均体积=
mL=15.3mL,根据(NH4)2SO4---2NaOH得m[(NH4)2SO4]=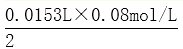
(4)在滴定实验结束后发现滴定用的碱式滴定管玻璃尖嘴内出现了气泡,滴定开始时无气泡,导致NaOH溶液的量偏小,根据(NH4)2SO4---2NaOH得,导致测定N含量偏小;
(5)因为氢氧化钠和碳酸氢根离子反应生成氢氧化钠反应,所以会导致测量结果偏大,故答案为:否;用氢氧化钠标准溶液滴定时,溶液中HCO3-中的H+也会和氢氧化钠中和.
考查方向
解题思路
(1)本题考查实验装置的选择和连接,实验装置的连接顺序为发生装置、净化装置、干燥装置、性质或收集装置、尾气处理装置。一般除杂在前,干燥在后;若是燃烧管除杂,则干燥在前;若用洗气瓶,则“长进短出”,若用干燥管,则“大进小出”;根据题意知,装有氢氧化钠溶液的洗气瓶为二氧化碳的吸收装置,为保证实验结果准确,必须防止水蒸气和外界空气的干扰;为保证分液漏斗内液体顺利流下,应选第二个装置作为二氧化碳的发生装置;根据上述分析连接次序为:b-e,f-h,g-c;
(2)盐酸和硝酸易挥发,会干扰二氧化碳的测定,氢氧化钠溶液与样品反应不会生成二氧化碳,所以分液漏斗内的液体应为稀硫酸,选B;
(3)(NH4)2SO4属于强酸弱碱盐,水解显酸性,所以用酸式滴定管准确取出20.00mL的溶液;滴定终点的pH约为8.8,酚酞变色范围为8.2——10,应用酚酞作指示剂;用浓度为0.08mol/L氢氧化钠标准溶液滴定,达滴定终点时的现象为溶液从无色变为浅红色 ,且30s内不褪色;分析题给数据知,第二组数据误差较大,应舍弃,所用氢氧化钠溶液的体积为15.00mL 根据题给反应得氮原子与氢氧化钠之间的关系式:N——NaOH,代入数据计算可得,0.6g样品中含氮原子的物质的量为0.08mol/L×0.015L×5=0.006mol,其质量为0.084g,质量分数为14%;
(4)在滴定实验结束后发现滴定用的碱式滴定管玻璃尖嘴内出现了气泡,滴定开始时无气泡,代入计算得氢氧化钠溶液的体积偏小,则此实验测定的含氮量比实际值偏小;
(5).如果测定碳酸氢铵中的含氮量时,使用甲醛法不合理,理由是因为用氢氧化钠标准溶液滴定时,溶液中HCO3—中的H+也会和氢氧化钠中和。
易错点
(1)一般除杂在前,干燥在后;若是燃烧管除杂,则干燥在前;若用洗气瓶,则“长进短出”,若用干燥管,则“大进小出”;
(2)盐酸和硝酸易挥发,会干扰二氧化碳的测定
知识点
11.【化学-选修2:化学与技术】
《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一。水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水质优劣直接影响人体健康。海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景。人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法。
(1)天然水在净化处理过程中加入明矾做混凝剂,其净水作用的原理是_________(用离子方程式表示)
(2)家庭用水可以用肥皂水检验其硬度,因为 。家用净水器中装有活性炭和阳离子交换树脂(NaR),用过的阳离子交换树脂放入 中可再生。
(3)电渗析法淡化海水的示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。
阳极的主要电极反应式是________。在阴极附近加入无色酚酞,看到的现象是___________________________。淡水的出口为________(填“a”“b”或“c”)。
(4)利用海水制得的食盐,制取纯碱的简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱。
①滤出晶体C后,从滤液D中提取氯化铵有两种方法:
方法一、通入氨,冷却、加食盐,过滤;
方法二、不通氨,冷却、加食盐,过滤。
对两种方法的评价正确的是(选填编号)_____________。
a.方法一析出的氯化铵纯度更高
b.方法二析出的氯化铵纯度更高
c.方法一的滤液可直接循环使用
d.方法二的滤液可直接循环使用
②提取的NH4Cl中含有少量Fe2+、SO42―。将产品溶解,加入H2O2,加热至沸,再加入BaCl2溶液,过滤,蒸发结晶,得到工业氯化铵。加热至沸的目的是___________。滤渣的主要成分是_______________、____________________。
正确答案
(1)Al3++3H2O
(2)硬脂酸钠与硬水中的钙离子、镁离子形成硬脂酸钙、硬脂酸镁沉淀 食盐水
(3)2Cl--2e-===Cl2↑ 阴极附近溶液变红色,有无色气体放出 b
(4)① a d ② 使Fe3+完全水解为Fe(OH)3
Fe(OH)3 BaSO4
解析
(1)混凝剂是吸附水中的微小悬浮颗粒,凝聚成较大的颗粒,而快速沉降的主要作用,要具备水解生成胶体的性质,所以常有铝盐或铁盐在水中发生水解生成相应氢氧化物胶体,如明矾,铝离子水解生成氢氧化铝胶体和氢离子,氢氧化铝胶体具有吸附性,所以能净水,水解方程式为Al3++3H2O⇌Al(OH)3+3H+;
(2)肥皂中含有高级酯肪酸钠,能与硬水中的钙离子、镁离子形成硬脂酸钙、硬脂酸镁沉淀;用过的阳离子交换树脂中钠离子被钙、镁离子交换掉了,要再生可以放在食盐中,将钙镁离子再换成钠离子, 故答案为:高级酯肪酸钠能与硬水中的钙离子、镁离子形成硬脂酸钙、硬脂酸镁沉淀;食盐水;
(3)依据电渗析法淡化海水示意图分析,阴(阳)离子交换膜仅允许阴(阳)离子通过,所以阳极上是阴离子失电子发生氧化反应,海水中的氯离子失电子生成氯气,电极反应为:2Cl--2e- =Cl2↑,阴极是氢离子得到电子发生还原反应生成氢气,阴极附近氢氧根离子浓度增大,在阴极附近加入无色酚酞,可以看到阴极附近溶液变红色,有无色气体放出;在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,所以水在b处流出;阴极附近溶液变红色,有无色气体放出;b;
(4)①滤液D中含有碳酸氢钠和氯化铵,a.方法一通入氨,使溶液中的碳酸氢钠生成碳酸钠,再加食盐,过滤,析出的氯化铵纯度更高,故a正确; b.方法二没有通氨气,冷却、加食盐,过滤,析出的氯化铵中会有碳酸氢钠,纯度不高,故b错误; c.方法一的滤液含有碳酸钠不可直接循环使用,故c错误; d.方法二的滤液主要成分还是碳酸氢钠和氯化铵,还有氯化钠,可直接循环使用,故d正确; 故选ad;
②提取的NH4Cl中含有少量Fe2+、SO42-.将产品溶解,加入H2O2,将亚铁离子氧化成铁离子,加热至沸,促使铁离子水解生成氢氧化铁沉淀,再加入BaCl2溶液,使硫酸根离子沉淀,过滤,蒸发结晶,得到工业氯化铵。
考查方向
解题思路
(1)混凝剂是溶液中水解生成胶体的盐类,净水作用是吸附悬浮杂质使其聚沉达到净化目的;明矾可水解生成具有吸附性的胶体;
(2)肥皂中含有高级酯肪酸钠,能与钙离子生成沉淀;用过的阳离子交换树脂中钠离子被钙、镁离子交换掉了,要再生可以放在食盐中,将钙镁离子再换成钠离子;
(3)依据电渗析法淡化海水示意图分析,阴(阳)离子交换膜仅允许阴(阳)离子通过.所以阳极上是阴离子失电子发生氧化反应,海水中的氯离子失电子生成氯气;阴极是氢离子得到电子发生还原反应生成氢气,阴极附近氢氧根离子浓度增大;在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,所以水在b处流出;
(4)①滤液D中含有碳酸氢钠和氯化铵,a.方法一通入氨,使溶液中的碳酸氢钠生成碳酸钠,再加食盐,过滤,析出的氯化铵纯度更高; b.方法二没有通氨气,冷却、加食盐,过滤,析出的氯化铵中会有碳酸氢钠,纯度不高; c.方法一的滤液含有碳酸钠不可直接循环使用; d.方法二的滤液主要成分还是碳酸氢钠和氯化铵,还有氯化钠,可直接循环使用;
②提取的NH4Cl中含有少量Fe2+、SO42-.将产品溶解,加入H2O2,将亚铁离子氧化成铁离子,加热至沸,促使铁离子水解生成氢氧化铁沉淀,再加入BaCl2溶液,使硫酸根离子沉淀,过滤,蒸发结晶,得到工业氯化铵,据此答题。
易错点
依据电渗析法淡化海水示意图分析,阳极上是阴离子失电子发生氧化反应;阴极是氢离子得到电子发生还原反应生成氢气;在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,所以水在b处流出。
知识点
二氯化砜(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2反应制取少量的SO2Cl2。装置如图(有些支持装置省略了)所示。
已知SO2Cl2的熔点为-54.1℃,沸点为69. 1℃;常温下比较稳定,受热易分解,遇水能发生剧烈的水解反应,产物之一为氯化氢气体。
8.E中的试剂是饱和食盐水,戊是贮气装置, 则F瓶中气体的实验室制法是_________(用方程式表示);
9.B处反应管冷却水应从 (填“a”或“b”)接口通入;
10.装置乙和丁的作用是____________;
11.恒压漏斗具有特殊的结构,主要目的是___________;
12.写出二氯化砜(SO2Cl2)水解反应的方程式________________;
13.SO2溶于水生成亚硫酸,亚硫酸的酸性强于次氯酸,选用下面的装置和药品探究亚硫酸与次氯酸的酸性强弱:

装置连接顺序为A、 、 、 、D、F,其中E的作用是 ,通过 现象即可证明亚硫酸的酸性强于次氯酸。
正确答案
MnO2+4HCl(浓) = MnCl2+Cl2↑+2H2O或2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
解析
E中的试剂是饱和食盐水,戊是贮气装置, 则F瓶中气体的实验室制法是MnO2+4HCl(浓) = MnCl2+Cl2↑+2H2O或2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O;
考查方向
解题思路
戊是制取氯气的装置,甲是制备二氧化硫的装置,同于浓硫酸反应需要加热,硝酸能氧化二氧化硫。
正确答案
a
解析
B处反应管冷却水应从a接口通入
考查方向
解题思路
B处反应管冷却水应从a接口通入
正确答案
干燥SO2和 Cl2,防止SO2Cl2发生水解反应
解析
装置乙和丁的作用是干燥SO2和 Cl2,防止SO2Cl2发生水解反应。
考查方向
解题思路
因蛇形冷凝管的作用是冷凝回流而反应又没有加热,故二氧化硫与氯气间的反应时放热反应,由于有一部分氯气、二氧化硫通过冷凝管逸出,故C中使用碱性试剂,又因为SO2Cl2遇水易水解,故碱石灰是用于吸收氯气、二氧化硫并防止空气中的水蒸气进入B中。
正确答案
使所加的液体能顺利滴入烧瓶中
解析
恒压漏斗具有特殊的结构,主要目的是使所加的液体能顺利滴入烧瓶中。
考查方向
解题思路
由于恒压漏斗中的液体坑定可以全部流下,故应该塞号恒压漏斗上方的塞子,通过E向F中加水,根据水最终能否全部进入F中判断装置气密性是否符合要求。
正确答案
SO2Cl2+H2O=H2SO4+2HCl
解析
写出二氯化砜(SO2Cl2)水解反应的方程式SO2Cl2+H2O=H2SO4+2HCl
考查方向
解题思路
因氯水不溶于饱和食盐水,故E中的试剂是饱和食盐水,氯气在水存在的条件下可将二氧化硫氧化成硫酸,自身还原为氯化氢。SO2+Cl2+2H2O=H2SO4+2HCl
正确答案
C B、E; 除去SO2气体(,若答除杂质气体不给分);当D中品红不褪色,F中出现白色沉淀
解析
HCl滴入亚硫酸钙产生SO2,SO2通入漂白粉次氯酸钙溶液中产生沉淀和次氯酸.原理都是强酸制弱酸,所以亚硫酸比次氯酸强。SO2溶于水生成亚硫酸,亚硫酸的酸性强于次氯酸,选用装置和药品探究亚硫酸与次氯酸的酸性强弱: SO2通入NaHCO3中,产生CO2.装置连接顺序为A、C B、E、D、F,A是产生SO2,B是除去HCl杂质使SO2纯净,E的作用是除去SO2气体,通过当D中品红不褪色,F中出现白色沉淀现象即可证明亚硫酸的酸性强于次氯酸。
考查方向
解题思路
HCl滴入亚硫酸钙产生SO2,SO2通入漂白粉次氯酸钙溶液中产生沉淀和次氯酸.原理都是强酸制弱酸,所以亚硫酸比次氯酸强。
扫码查看完整答案与解析