- 海水资源及其综合利用
- 共118题
8.下列离子方程式书写正确的是 ( )
正确答案
解析
A.大理石与盐酸反应的离子方程式应为CaCO3+2H+=Ca2++H2O+CO2↑,故A错误;
B.氢氧化铝固体与盐酸反应的离子方程式应为Al(OH)3+H+=Al3++3H2O,故B错误;
C.氯化镁溶液中滴入氢氧化钠溶液反应的离子方程式应为Mg2++2OH−=Mg(OH)2↓,故C错误;
D.氯化钡溶液中滴入硫酸钠溶液生成硫酸钡沉淀,反应的离子方程式为Ba2++SO42−=BaSO4↓,
故D正确.
考查方向
解题思路
大理石不溶于水,应写成化学式;氢氧化铝不溶于水,应写成化学式;氯化镁溶于水且电离呈离子;氯化钡溶液中滴入硫酸钠溶液生成硫酸钡沉淀.
易错点
不能熟练掌握离子方程式的书写,缺乏元素化合物知识的综合应用能力,没有把握离子方程式的书写方法,离子反应要符合反应的实际,易错点为A和B,注意物质的化学式。
知识点
9. 已知:2SO2 (g)+ O2(g) 
下列说法不正确的是
正确答案
知识点
11. 下表中“试剂”与“操作及现象”对应关系错误的是
正确答案
知识点
9.煤矸石是采煤和洗煤时的废弃物,其主要成分是








正确答案
解析
A.煤矸石主要成分是Al2O3.SiO2,Al2O3.SiO2均难溶于水,故A错误;
B.P2O5和SO3对应水化物的酸为磷酸.硫酸,硫酸为强酸,所以酸性较强的是H2SO4,故B错误;
C.煤矸石主要成分是Al2O3.SiO2,可用于生产矸石水泥.耐火砖等建筑材料,故C正确;
D.SiO2不能溶于盐酸,所以用盐酸可以溶解煤矸石中的部分氧化物如Al2O3,而SiO2不能溶,故D错误.
故选:C.
考查方向
解题思路
Al2O3.SiO2均难溶于水;P2O5和SO3对应水化物的酸为磷酸.硫酸,硫酸酸性强;煤矸石主要成分是Al2O3.SiO2,熔点高硬度大;SiO2不能溶于盐酸.
易错点
不能熟练掌握物质分类方法和物质性质的判断,主要是两性氧化物.碱性氧化物性质的分析判断.
知识点
12.下图是电解
正确答案
解析
在电解池中,电流的流向和电子的移动方向相反,电流是从正极流向阳极,所以c是阳极,d是阴极,a是正极,b是负极.
A.阳极上氢氧根离子失电子生成氧气,阴极上氢离子得电子生成氢气,故A正确;
B.由分析可知,d为阴极.c为阳极,故B正确;
C.d极上氢离子得电子生成氢气,c极上氢氧根离子失电子生成氢离子,所以溶液的pH不会升高,故C错误;
D.电解过程中,阴离子向阴极移动,故D正确.
故选C。
考查方向
解题思路
在电解池中,电流的流向和电子的移动方向相反,电流是从正极流向阳极,所以c是阳极,d是阴极,a是正极,b是负极,据此分析.
易错点
不清楚电解池的工作原理,不会根据电子流向和电流流向判断电源的正负极,从而确定电极的阴阳极,缺乏分析能力.
知识点
4.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是()
正确答案
解析
A.自由移动的溴离子能和硝酸银溶液反应生成淡黄色沉淀,往溴乙烷中滴入硝酸银溶液,振荡,没有沉淀,说明溴乙烷中不含溴离子,故A正确;B.能和氯化钡反应生成白色沉淀的离子可能是硫酸根离子或银离子,向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成,溶液中可能含有硫酸根离子,也可能含有银离子,故B错误;C.硫酸是强酸、硫化氢是弱酸,硫酸铜和硫化氢反应生成不溶于稀硫酸的CuS,故C错误;D.将铝箔用坩埚钳夹住放在酒精灯火焰上加热,铝和氧气反应生成了氧化铝,形成氧化膜,三氧化二铝的熔点高于铝的熔点,包住了熔化的铝,所以加热铝箔的时候铝熔化了但是不会滴落,故D错误。
故选A
考查方向
解题思路
A.自由移动的溴离子能和硝酸银溶液反应生成淡黄色沉淀;B.能和氯化钡反应生成白色沉淀的离子可能是硫酸根离子或银离子;C.硫酸是强酸、硫化氢是弱酸;D.三氧化二铝的熔点高于铝的熔点,所以铝箔在酒精灯上加热到熔化,熔化的铝并不滴落.
易错点
对实验原理和操作方法理解和记忆不够透彻
知识点
7.下列说法正确的是
正确答案
解析
A.pH=2的H2C2O4溶液与pH=12的NaOH溶液等体积混合,根据电荷守恒可知:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-) +2c( C2O42-),A错误;
B.Na2S和ZnSO4反应有白色沉淀ZnS生成,Na2S和CuSO4反应有黑色沉淀CuS生成,5ml 0.1mol/LNa2S溶液明显过量,无法证明沉淀转化,则无法证明Ksp(ZnS)
C.在Na2HPO4水溶液中,根据物料守恒可知:存在关系式:2c(H3PO4)+2c(H2PO4-)+2c(HPO42-)+2c(PO43-)=c(Na+),C错误;
D.一定温度下,Kw=l×10-13,pH=8的NaOH溶液c(OH-)=10-5,pH=5的H2SO4溶液c(H+)=10-5,保持温度不变,欲使混合溶液pH=7,设NaOH溶液的体积为V1,H2SO4溶液的体积为V2,(10-5V1-10-5V2)/(V1+V2)=10-6,V1:V2=11︰9,D正确。
故选D。
考查方向
解题思路
A.pH=2的H2C2O4溶液与pH=12的NaOH溶液等体积混合,根据电荷守恒可知;
B.5ml 0.1mol/LNa2S溶液明显过量,无法证明沉淀转化;
C.在Na2HPO4水溶液中,根据物料守恒可知;
D.注意水的浓度积常数的应用及pH计算。
易错点
本题考查较为综合,涉及离子浓度大小比较、盐类的水解、弱电解质的电离以及难溶电解质的溶解平衡等问题,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意相关基础知识的积累,难度中等。
知识点
6.下列有关海水综合利用的说法正确的是
正确答案
解析
A、溴元素在海水中以化合态存在,将元素由化合态转化为游离态时发生电子转移,所以一定发生氧化还原反应,生成溴单质然后,用有机萃取,故A错误;
B、钠易与水反应,电解饱和食盐水得到氢氧化钠、氯气和氢气,应用电解熔融的氯化钠的方法冶炼钠,故B错误;
C、蒸发是根据物质的沸点进行分离的操作,为物理变化,故C正确;
D、加入过量的氯水能将I2氧化成更高价的化合物,减少碘的产率,故D错误;
考查方向
物质的分离提纯和鉴别
解题思路
A、海水中提取溴单质,Br元素化合价由-1价变为0价;
B、电解饱和食盐水得到氢氧化钠、氯气和氢气;
C、蒸发为物理变化;
D、加入过量的氯水能将I2氧化成更高价的化合物
易错点
D项中过量氯气可将I-氧化为更高价态的化合物
教师点评
本题考查了海水资源的开发和利用,侧重于化学与生活、生产的考查,有利于培养学生良好的科学素养,根据基本概念结合物质转化方式来分析解答,知道从海水中提取溴的方法,题目难度不大
知识点
17.室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是
正确答案
解析
混合溶液的pH=7,说明溶液中c(H+)=c(OH-);
A.向0.10mol•L-1CH3COONa溶液中通入HCl,至溶液pH=7,c(H+)=c(OH-),HCl不足,反应后溶液中溶质为NaCl、醋酸和醋酸钠,由电荷守恒可知,c(Na+)=c(CH3COO-)+c(Cl-),由物料守恒可知,c(Na+)=c(CH3COOH)+c(CH3COO-),则c(Na+)>c(CH3COOH)=c(Cl-),故A正确;
B.溶液中钠离子与S原子物质的量之比为1:1,而铵根离子与部分亚硫酸根结合,故c(Na+)>c(NH4+),由物料守恒可知,c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3),溶液呈中性,由电荷守恒可得:c(Na+)+c(NH4+)=2c(SO32-)+c(HSO3-),联立可得:c(NH4+)+c(H2SO3)=c(SO32-),故B错误;
C.向0.10mol•L-1Na2SO3溶液通入SO2,发生Na2SO3+SO2+H2O=2NaHSO3,至溶液pH=7,反应后溶液中溶质为的NaHSO3、Na2SO3,则c(Na+)<2[c(SO32-)+c(HSO3-)+c(H2SO3)],故C错误;
D.溶液中存在电荷守恒,根据电荷守恒得c(NH4+)=c(HCO3-)+2c(CO32-),故D错误;
考查方向
离子浓度大小比较
解题思路
混合溶液的pH=7,说明溶液中c(H+)=c(OH-);
A.向0.10mol•L-1CH3COONa溶液中通入HCl,至溶液pH=7,反应后溶液中溶质为NaCl、醋酸和醋酸钠;
B.溶液中钠离子与S原子物质的量之比为1:1,而铵根离子与部分亚硫酸根结合,由物料守恒可知,c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3),溶液呈中性,由电荷守恒可得:c(Na+)+c(NH4+)=2c(SO32-)+c(HSO3-),联立判断;
C.未反应前结合物料守恒可知c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)],向0.10mol•L-1Na2SO3溶液通入SO2,至溶液pH=7,反应后溶液中溶质为NaHSO3、Na2SO3;
D.溶液中存在电荷守恒,根据电荷守恒判断
易错点
溶液中的电荷守恒、物料守恒
教师点评
本题考查离子浓度大小比较,明确盐类水解、弱电解质的电离及物质之间发生的反应是解本题关键,注意题给信息的灵活运用,会正确运用守恒解答问题,题目难度不大
知识点
19.一定温度下,向某密闭容器中以物质的量1:1冲入适量X(g)和Y,发生可逆反应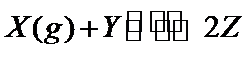

正确答案
解析
根据可逆反应X(g)+Y
考查方向
化学平衡
解题思路
扩大一倍容积,平衡时X的浓度不变,说明,减小压强时,平衡向生成X的方向移动,根据此分析解答
易错点
扩大容积相当于浓度减小,体积扩大一倍时等效于浓度减小一倍
教师点评
本题考查化学平衡的影响因素,题目难度不大
知识点
扫码查看完整答案与解析








