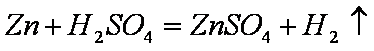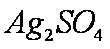- 原电池和电解池的工作原理
- 共168题
以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是
正确答案
解析
电镀时Zn 为阳极,Fe为阴极,KCl、ZnCl2的混合溶液为电解质溶液,若未通电,不存在自发进行的氧化还原反应,故不能构成原电池,故A错;电镀时,导线中每通过2 mol电子,就会析出1mol锌,通过的电量与析出的锌量的关系确定,故B错;电镀时保持电流保持恒定,则反应的速率就不会改变,故升高温度对反应的速率无影响,故C正确;镀锌层破损后,锌与铁可构成原电池的两个电极,铁做正极受到保护,故D错。
知识点
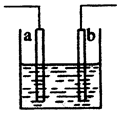
右图装置中发生反应的离子方程式为:Zn+2H+→Zn2++H2↑,下列说法错误的是
正确答案
解析
本题通过电化学知识意在考查考生的电化学知识和考生对问题的分析、处理能力。图示装置既可以是电解池,阳极的电极材料为Zn、阴极的电极材料为Zn或其他可导电的材料,如Cu、石墨等,电解质溶液为盐酸或硫酸等,故A项错、B项正确;该装置也可是原电池,此时电池负极材料为Zn、正极材料为比Zn活泼性差的可导电的材料,如Cu、石墨等,电解质溶液为盐酸或硫酸等,故C、D项正确。
知识点
银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故,根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去,下列说法正确的是
正确答案
解析
A错,银器放在铝制容器中,由于铝的活泼性大于银,故铝为负极,失电子,银为正极,银表面的Ag2S得电子,析出单质银附着在银器的表面,故银器质量增加;
C错,Al2S3在溶液中不能存在,会发生双水解反应生成H2S和Al(OH)3;
D错,黑色褪去是Ag2S转化为Ag而不是AgCl
知识点
下列实验操作正确的是( )
正确答案
解析
银与氨水不反应,故A错;硅酸钠具有粘性,能将玻璃塞和玻璃瓶粘在一起,故硅酸钠溶液不能保存在带玻璃塞的试剂瓶中,B错;将三氯化铁溶液蒸干,由于HCl具有挥发性,三氯化铁会水解彻底,生成Fe(OH)3,故C错;锌能置换出铜,构成原电池加快了反应速率,故D正确。
知识点
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题;
(1)上述实验中发生反应的化学方程式有
(2)硫酸铜溶液可以加快氢氯生成速率的原因是
(3)实验室中现在Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是 ;
(4)要加快上述实验中气体产生的速率,还可采取的措施有
(答两种);
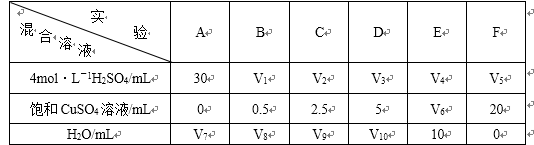
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集4产生的气体,记录获得相同体积的气体所需时间。
①请完成此实验设计,其中:V1= ,V6= ,V9= ;
②反应一段时间后,实验A中的金属呈 色,实验E中的金属呈 色;
③该同学最后得出的结论为;当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因 。
正确答案
(1)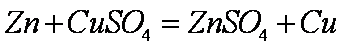
(2)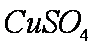
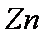
(3)
(4)升高反应温度、适当增加硫酸的浓度、增加锌粒的比表面积等
(5)①30 10 17.5
②灰黑 暗红
③当加入一定量的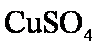
解析
(1)上述实验中发生反应的化学方程式有Zn+CuSO4==ZnSO4+Cu和Zn+H2SO4==ZnSO4+H2。
(2)由于生成了铜,因此已经构成了Zn—Cu原电池,这样便加快了氢气产生的速率。
(3)根据金属活动性顺序表,能与Zn发生置换反应的只有Ag2SO4。
(4)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度、适当增加硫酸的浓度、增大锌粒的表面积等。
(5)①因为生成相同体积的气体,而金属Zn是过量的,则4mol/L H2SO4的体积应相同,所以V1=V2=V3=V4=V5=30mL。又由F可知,溶液的总体积为V5+20 =30+20 =50 mL,因此V6=50 mL-10 mL-30=10 mL;V9=50 mL-2.5 mL-30 mL=17.5 mL。
②由于A中未加入饱和CuSO4溶液,则实验A中的金属呈灰黑色;而E中加入了10 mL的饱和CuSO4溶液,与金属Zn发生了反应生成了单质Cu并沉积在Zn的表面,故实验E中的金属呈暗红色。
③当加入少量CuSO4溶液时,由于构成了Zn—Cu原电池,因而生成氢气的速率会大大提高。当加入一定量的CuSO4后,生成的单质铜会沉积在Zn的表面降低了Zn与溶液接触的表面,使得氢气生成速率反而下降。
知识点
锌锰电池(俗称干电池)在生活中的用量很大。两种锌锰电池的构造图如图(甲)所示。
回答下列问题:
(1)普通锌锰电池放电时发生的主要反应为:
Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH
① 该电池中,负极材料主要是________,电解质的主要成分是______,正极发生的主要反应是________。
② 与普通锌锰电池相比,碱性锌锰电池的优点及其理由是_______。
(2)图(乙)表示回收利用废旧普通锌锰电池的一种工艺(不考虑废旧电池中实际存在的少量其他金属)。
① 图(乙)中产物的化学式分别为A_______,B________。
② 操作甲中得到熔块的主要成分是K2MnO4。操作b中,绿色的K2MnO4溶液反应后生成紫色溶液和一种黑褐色固体,该反应的离子方程式为_______。
③ 采用惰性电极电解K2MnO4溶液也能得到化合物D,则阴极处得到的主要物质是________。(填化学式)
正确答案
答案:
(1)①Zn;NH4Cl;
MnO2+e-+NH4+===MnOOH+NH3
(2)碱性电池不容易发生电解质溶液泄漏,因为消耗的负极改装在电池的内部;
碱性电池使用寿命长,因为金属材料在碱性电解质比在酸性电解质的稳定性好;
(3)ZnCl2; NH4Cl;
①3MnO42-+2CO2===2MnO4-+MnO2+2CO32-;
②H2;
解析
略
知识点
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知: 33CH4(g)+H2O(g)=CO(g)+3H2(g) △H=206.2kJ·mol-1
33CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=247.4 kJ·mol-1
2H2S(g)=2H2(g)+S2(g) △H=169.8 kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为_________。
(2)H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是_________。燃烧生成的SO2与H2S进一步反应,生成物在常温下均非气体,写出该反应的化学方程式:_________。
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图11所示。图中A、B表示的物质依次是_________。
(4)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图见图12(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为_________。
(5)Mg2Cu是一种储氢合金。350℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。Mg2Cu与H2反应的化学方程式为_________。
正确答案
(1)CH4(g)+2H2O(g) =CO2(g) +4H2(g) △H=165.0 kJ·mol-1
(2)为H2S热分解反应提供热量;2H2S+SO2 =2H2O+3S (或4H2S+2SO2=4H2O+3S2)
(3)H、O(或氢原子、氧原子)
(4)CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O
(5)2Mg2Cu+3H2
解析
略。
知识点
①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池,①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少。据此判断这四种金属活动性由大到小的顺序是
正确答案
解析
由题意知:①②③④ 四种金属片两两相连浸入稀硫酸中都可组成原电池 ,①②相连时,外电路电流从②流向①,则① 大于②;
知识点
用电解法提取氯化铜废液中的铜,方案正确的是
正确答案
解析
电解氯化铜溶液时氯离子在阳极放电生成氯气,铜离子在阴极放电生成铜,因此铜片应连接电源的负极,A项错误;碳棒做阳极、铜片做阴极,B项正确;C项用氢氧化钠溶液吸收阳极产物;D项应用湿润的淀粉碘化钾试纸检验氯气。
知识点
锂离子电池的应用很广,其正极材料可再生利用。某锂离子电池正极材料有钴酸锂(LiCoO2),导电剂乙炔黑和铝箔等。充电时,该锂离子电池负极发生的反应为6C+xLi++xe-=LixC6。现欲利用以下工艺流程回收正极材料中的某些金属资源 (部分条件未给出)
回答下列问题:
(1)LiCoO2 中,Co元素的化合价为___________。
(2)写出“正极碱浸”中发生反应的离子方程式_________________________________。
(3) “酸浸”一般在80 oC下进行,写出该步骤中发生的所有氧化还原反应的化学方程式__________________;可用盐酸代替H2SO4和H2O2 的混合液,但缺点是_________。
(4)写出“沉钴”过程中发生反应的化学方程式_____________。
(5)充放电过程中发生LiCoO2与Li1-xCoO2之间的转化,写出放电时电池反应方程式___________________。
(6)上述工艺中“放电处理”有利于锂在正极的回收。其原因是___________________________。在整个回收工艺中,可回收的金属化合物有_________________(填化学式)
正确答案
(1)+3;
(2)2Al+2OH—+2H2O=2AlO2—+3H2↑
(3)2LiCoO2+3H2SO4+H2O2

(4)CoSO4+2NH4HCO3=CoCO3↓+(NH4)2SO4+H2O+CO2↑
(5)Li1-xCoO2+ LixC6= LiCoO2+6C
(6)Li+从负极脱出,经电解液向正极移动并进入正极材料中;Al(OH)3、CoCO3、Li2SO4
解析
略
知识点
扫码查看完整答案与解析