- 原电池和电解池的工作原理
- 共168题
10.关于下列各装置图的叙述不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27. 次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性。回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式_______________________。
(2)H3PO2和NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。
①H3PO2中,P元素的化合价为__________;
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为___________(填化学式);
③NaH2PO2为___________(填“正盐”或“酸式盐”),其溶液显___ ____(填“弱酸性”、“中性”或“弱碱性”)。
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应,写出白磷与Ba(OH)2溶液反应的化学方程式______________________。
(4)H3PO2也可用电渗析法制备。“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
①写出阳极的电极反应式_________________ ___________________;
②分析产品室可得到H3PO2的原因__________________ _________________;
③早期采用“三室电渗析法”制备H3PO2:将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。其缺点是产品中混有________杂质,该杂质产生的原因是 ________________ 。
正确答案
(1)H3PO2
(3)2P4+3Ba(OH)2+6H2O=2PH3↑+3Ba(H2PO2)2
(4)①2H2O-4e-=4H++O2↑或4OH--4e-=2H2O+O2.
②由于阳极室OH-放电,造成H+浓度增大,通过阳膜扩散进入产品室,而原料室中的H2PO2-可以通过阴膜进入产品室,二者反应生成H3PO2.
③H3PO4或PO43-。由于H3PO2具有还原性,电解时就会有H3PO2在阳极放电而被氧化生成H3PO4。
解析
解析已在路上飞奔,马上就到!
知识点
28. NO2压缩成N2O4可作火箭燃料中的氧化剂,也可制备硝化试剂N2O5等。
(1)火箭燃料燃烧反应如下:
2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)
若1.00 g N2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14 kJ的热量。则该反应的△H = ____________kJ·mol-1。
(2)在2 L密闭容器内,投入一定量NO2,发生下列反应:2NO2(g)
①不能说明该反应已达到平衡状态的是________________(填字母)。
a.v正(NO2)=2v逆(O2)
b.c(NO2)= c(NO)
c.气体总压不变
d.NO的体积分数保持不变
②下列说法正确的是______________(填字母)。
a.三个实验开始投入的NO2的物质的量均为1.0 mol
b.实验Ⅱ和实验Ⅰ相比,可能隐含的条件是:实验Ⅱ使用了效率更高的催化剂
c.该反应是放热反应
d.实验Ⅰ条件下反应的平衡常数大于实验Ⅲ条件下反应的平衡常数
e.800℃时,该反应的平衡常数为0.25
f.该反应的△S>0,故该反应一定是自发反应
③实验Ⅱ从反应开始到刚达到平衡时,v(O2)=( )mol·L-1·min-1;若再向该2 L密闭容器中通入1 mol NO2、1 mol NO、0.5 mol O2,则平衡将( )移动(填“向右”、“向左”或“不”)。
(3)利用NO2或N2O4可制备N2O5,原理如下图所示。N2O5在电解池的_____________
(填“阴极”或“阳极”)区生成,其电极反应式为( )。
正确答案
(1)-1224.96
(2)①b ②be ③0.0125 向左
(3)阳极 N2O4+2HNO3-2e-=2N2O5+2H+
解析
解析已在路上飞奔,马上就到!
知识点
31.镍、钴、铈、铬虽然不是
(1)二氧化铈(CeO2)是一种重要的稀土氧化物,在平板电
(2)某锂离子电池含Li+导电固体为电解质。充电时,Li+还原为Li,并以原子形式嵌入电极材料碳(C6)中,以LiC6表示,电池反应为LiCoO2+ C6
(3)自然界Cr主要以三价Cr和六价Cr的形式存在。六价Cr能引起细胞的突变和癌变。可以用亚硫酸钠将其还原为三价铬,完成并配平下列离子方程式:
Cr2O72-+__SO32-+__H+=__Cr3++__SO42-+
(4)NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Zn、Fe等元素)为原料获得。操作步骤如下:
向滤液Ⅰ中加入FeS主要目的是除去Cu、Zn等杂质,除去Cu2+的离子方程式为_____________。
②向滤液Ⅱ中加入H2O2,溶液中发生反应的离子方程式为__________________,调节pH的目的是______________________。
③滤液Ⅲ溶质的主要成分是NiSO4,再加入碳酸钠过滤后,加稀硫酸溶解又生成NiSO4的目的______________。
④我国第五套人民币中的一元硬币材料为钢芯镀镍,镀镍时,镍应作_____极。
正确答案
(1)还原;2mol
解析
解析已在路上飞奔,马上就到!
知识点
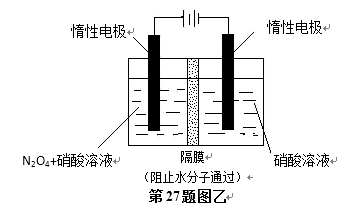
27.二氧化硫和氮氧化物(NOx)对大气污染日趋严重,研究消除大气污染的方法是化学工作者的重要课题,目前有很多种方法消除大气污染。
(1)可利用甲烷催化还原NOx的方法处理NOx ,反应如下:
(3)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42- 而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为( );
(4)肼(N2H4)用亚硝酸氧化可生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977。写出肼与亚硝酸反应的化学方程式( );
(5)N2O5是重要的硝化剂和氧化剂,可用电解法制备N2O5,如图乙所示,N2O5在电解池的 ( )(填“阳极”或“阴极”)区生成,其电极反应式为( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.按要求完成下列各小题。
Ⅰ、CO和H2的混合气体俗称合成气,是一种重要的工业原料气,焦炭、天然气(主要成分为CH4)、重油、煤在高温下均可与水蒸气反应制得合成气。
(1)已知某反应的平衡常数表达式为:
它所对应的化学方程式为:( )。
(2)向体积为2L的密闭容器中充入CH4和H2O(g)组成的混合气(共1mol),在一定条件下发生反应,并达到平衡状态,测得温度、压强、投料比X〔n(CH4)/n(H2O)〕对该反应的影响如图所示。
①图1中的两条曲线所示投料比的关系X2 ____ X1(填“=”“>”或“<”下同)
②图2中两条曲线所示的压强比的关系:P2 _______P1
(3)以CH4、O2为原料可设计成燃料电池:
①设装置中盛有150.0mL 1.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为4.48L,假设放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为:
②以H2SO4溶液代替KOH溶液为电解质溶液,将CH4改为C6H12O6 ,则燃料电池的负极反应式为:( )。
Ⅱ、(1)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11。在此温度下,将pH=2的H2SO4溶液VaL与pH=12的NaOH溶液VbL混合,若所得混合液为中性,则
Va︰Vb= ( )。
(2)在25℃时,将c mol·L-1的醋酸溶液与0.02 mol·L-1NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=____________________。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.化学能与电能之间的相互转化与人的生活实际密切相关,在生产、生活中有重要的应用,同时也是学生形成化学学科素养的重要组成部分。
(1)熔融状态下,钠的单质和氯化亚铁能组成可充电电池(如 图1),反应原理为:


充电时,__________(写物质名称)电极接电源的负极;
该电池的电解质为_________。
(2)某同学用铜片、石墨作电极电解一定浓度的硫酸铜溶液(如图2),一段时间停止通电取出电极。若在电解后的溶液中加入0.98g氢氧化铜粉末恰好完全溶解,经测定所得溶液与电解前完全相同。请回答下列问题:

②电解过程中X电极上发生的电极反方应式是:( )
③如在电解后的溶液中加入足量的小苏打,充分反应后产生气体在标准状况下所占的体积是( )
(3)常温时,BaSO4的Ksp=1.08×10-10,现将等体积的BaCl2溶液与2.0×10-3mol/l的Na2SO4
溶液混合。若要生成BaSO4沉淀,BaCl2溶液的最小浓度为______________。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用右图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中,不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点

正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.能源问题是人类社会面临的重大课题,日本大地震引起的核泄漏事故引起了人们对核能源的恐慌。而甲醇是未来重要的绿色能源之一。以CH4和H2O为原料,通过下列反应来制备甲醇。
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为( )。
(2)将1.0molCH4和2.0molH2O(g)通人容积为100L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图一。

图一 图二
①假设100℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为 ( );
②100℃时反应I的平衡常数为( )。
(3)在压强为0.1MPa、温度为300℃条件下,将1.0molCO与2.0molH2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,平衡后将容器的容积压缩到原来的1/2,其他条件不变,对平衡体系产生的影响是( )(填字母序号)。
A.c(H2)减小
B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加
D.重新平衡时c(H2)/c(CH3OH)减小
E.平衡常数K增大
(4)工业上利用甲醇制备氢气的常用方法有两种:
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析