- 原电池和电解池的工作原理
- 共168题
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系。下列叙述错误的是
正确答案
解析
略
知识点
26.TiO2在工业生产和日常生活中有重要用途。
I.工业上用钛矿石(FeTiO3,含FeO、Al2O3、SiO2等杂质)经过下述反应制得:
其中,步骤②发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O。
(1)净化钛矿石时,是否需要除去杂质FeO?答:( )(填“需要”或“不需要”)。
(2)净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中发生反应的化学方程式。
答:( )。
II.TiO2可通过下述两种方法制备金属钛:
“方法一”是电解TiO2来获得Ti(同时产生O2):将处理过的TiO2作阴极,石墨为阳极,熔融CaCl2为电解液,用碳块作电解槽池。
(3)阴极反应的电极反应式为___________________________________。
(4)电解过程中需定期向电解槽池中加入碳块的原因是______________________。
“方法二”是先将TiO2与Cl2、C反应得到TiCl4,再用镁还原得到Ti。因下述反应难于发生:
TiO2 (s)+2Cl2 (g)
所以不能直接由 TiO2 和 Cl2 反应(即氯化反应)来制取TiCl4。当往氯化反应体系中加入碳后,碳与上述反应发生耦合,使得反应在高温条件下能顺利进行。
(5)已知:C(s)+O2 (g) = CO2 (g) ΔH=-394 kJ·mol-1。请填空:
TiO2 (s)+C (s)+2Cl2 (g) = TiCl4 (l)+CO2 (g) ΔH= ______________
(6)从化学平衡的角度解释:往氯化反应体系中加入碳时,氯化反应能顺利进行的原因。
答:____________________________________________。
正确答案
(1)不需要
(2)Al2O3+2NaOH=2NaAlO2+H2O ; SiO2+2NaOH=Na2SiO3+H2O
(3)TiO2+4e-=Ti+2O2-(或Ti4++4e-=Ti)
(4)碳单质会与阳极产生的氧气反应而不断减少
(5)-243 kJ·mol-1
(6)碳单质与氧气反应减小产物浓度使平衡向右移动,导致反应顺利进行
解析
解析已在路上飞奔,马上就到!
知识点
27.A、B、C三种强电解质,它们在水中电离出的离子为Na+ 、Ag+ 、NO3- 、SO42- 、 Cl-,在如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、 B、 C三种溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙烧杯中c电极质量增加了10.8克。常温下各烧杯中溶液的pH与电解时间t的关系如图所示。据此回答下列问题:
(1)M为电源的_______极(填写“正”或“负”),甲、乙两个烧杯中的电解质分别为_______、_______(填写化学式)。
(2)计算电极f上生成的气体为_______mol。
(3)写出乙烧杯中的电解反应方程式:__________________________________________。
(4)若电解后甲溶液的体积为10L,则该溶液的pH为___________ 。
(5)要使丙恢复到原来的状态,应加入适量的( )(填写化学式)。
正确答案
(1)负 ; NaCl 、AgNO3
(2)0.025mol
(3)4AgNO3+2H2O= 4Ag+O2+4HNO3
(4)12
(5) H2O
解析
解析已在路上飞奔,马上就到!
知识点
碳及其化合物在科技、社会生产、生活中有着广泛的应用。请按要求回答下列问题:
23.已知:2CH4(g)+3O2(g)=2CO(g)+4H2O(l) △H1=﹣1214.6 kJ/mol
2CO(g)+O2(g)=2CO2(g) △H2=﹣566 kJ/mol
请写出CH4燃烧热的热化学方程式:______________________________________。
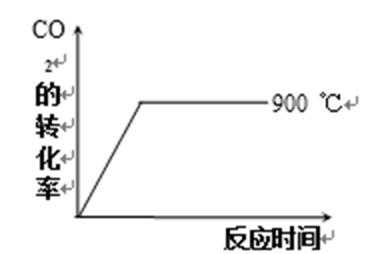
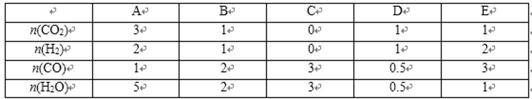
24.在不同温度下反应CO2(g)+H2(g) 
其他条件相同时,请在下图中画出750℃时CO2的转化率随时间变化的示意图。
25.以二甲醚(CH3OCH3)、空气、KOH溶液为原料可设计为燃料电池
①放电时,负极电极反应式:______________________________________。
②假设该燃料电池中盛有100.0 mL 3.0 mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为6.72 L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为_____________________________________________。
正确答案
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ/mol
考查方向
本题考查了热化学方程式的书写及燃烧热的概念
解题思路
根据燃烧热的定义,写方程式是可燃物只能是1mol:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=1/2△H1+1/2 △H2=-890.3 kJ/mol
易错点
忽略可燃物只能是1mol,即燃烧热的定义。
教师点评
本题考查了热化学方程式的书写,盖斯定律的应用及燃烧热的定义,在高考中出现频率高。
正确答案
考查方向
本题考查了化学平衡常数、化学平衡移动,化学反应速率,图像等知识点及学生分析图表获取信息的能力。
解题思路
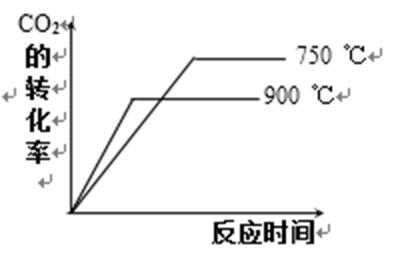
根据第一空,该反应为放热反应,750。C时,温度降低,速率减慢,达到平衡的时间变长,拐点延后,但平衡正移,二氧化碳转化率增大,平台高。
易错点
平衡移动和反应速率的影响结果混淆。
教师点评
本题考查了化学平衡常数、化学平衡移动,化学反应速率,图像等知识点及学生分析图表获取信息的能力。在高考中出现频率较高,但全国卷对该部分内容的考查难度稍大,本题难度较小。
正确答案
CH3OCH3-12e-+ 16OH-=2CO32-+11H2O(2分)
c(K+)>c (HCO3-)>c (CO32-)>c (OH-)>c( H+ ) (1分)
解析
由题意可知:
n(O2)=6.72/22.4 mol =0.3mol n(KOH)=0.3mol
n(e-)=4n(O2)=1.2mol 根据电子得失守恒:
n(CO2)=0.2mol
2KOH+ CO2= K 2 CO+ H 2 O
0.3 0.15 0.15
K 2 CO3+ H 2 O+ CO2=2KHCO3
0.05 0.05 0.1
即最终为n(K 2 CO3)=n(KHCO3)
碳酸钠水解程度大于碳酸氢钠,故得到答案结果。
考查方向
本题考查了燃料电池电极反应式书写、离子浓度大小的比较、计算等知识点。
解题思路
CH3OCH3-12e-+ 16OH-=2CO32-+11H2O
解题步骤:负极二甲醚放电,溶液呈碱性,碳元素的存在形态为CO32-,分析碳元素化合价,写出失去电子数,在根据电荷守恒配平OH-,根据原子守恒配平H2O
燃料电池都可以用这个模式来解题。
第二空见解析。
教师点评
本题考查了燃料电池电极反应式书写、离子浓度大小的比较、计算等知识点。难度较大,考查学生综合能力,在高考中出现频率中等。
5.模拟电渗析法将海水淡化的工作原理示意图如下。已知X、Y均为惰性电极,模拟海
水中富含Na+、Cl-、Ca2+、Mg2+、SO42-、HCO3-等离子。下列叙述中正确的是( )
正确答案
考查方向
本题考查了电解原理,电解电极反应是书写等知识。
解题思路
A.X为阴极,H离子放电,阳离子通过M补充阳离子,故为阳离子交换膜。根据放电顺序,Y极氯离子放电产生黄绿色气体。故A错
B.氢离子在x放电,Na+、Ca2+、Mg2+通过交换膜靠近x,氢氧化镁最先沉淀(根据溶解度),故B正确。
C.氢离子在x放电,,故电极反应式错误。
知识点
“8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN).请回答下列问题:
15.钠、钾着火,下列可用来灭火的是 .
16.白磷有毒能和氯酸(HClO3)溶液发生反应生成一种常见的强酸和一种三元酸,氧化剂是 ,氧化产物是 ,1mol P4参加反应转移 mol电子。
17.钠电池的研究开发在一定程度上可缓和因锂资源短缺引发的电池发展受限问题。
① 钠比锂活泼,用原子结构解释原因 。
②钠电池“ZEBRA”蓄电池的结构如图所示,电极材料多孔Ni/NiCl2和金属钠之间由钠离子导体制作的陶瓷管相隔。写出该电池的正极反应: 。
18.N2O5是一种新型硝化剂,如右图所示装置可用于制备N2O5,则N2O5在电解池的 (填“阳极”或“阴极”) 区生成,其电极反应式为 。
正确答案
解析
Na、K均与水反应,燃烧生成的过氧化氢均与二氧化碳反应生成氧气,则钠、钾着火,可用细沙盖灭来灭火,故答案为:C
考查方向
解题思路
Na、K均与水反应,燃烧生成的过氧化氢均与二氧化碳反应生成氧气,则钠、钾着火,可用细沙盖灭来灭火
易错点
忽略水可与钠、钾等金属反应生成可燃易爆的H2
正确答案
HClO3或氯酸 H3PO4或磷酸
解析
该反应中,P元素化合价由0价变为+5价,Cl元素的化合价由+5价变为-1价,得电子化合价降低的反应物是氧化剂,是电子化合价升高的反应物是还原剂,还原剂对应的产物是氧化产物,所以HClO3是氧化剂,H3PO4是氧化产物;
若1molP4参加反应转移电子的物质的量=1mol×4×(5-0)=20mol
考查方向
解题思路
该反应中,P元素化合价由0价变为+5价,Cl元素的化合价由+5价变为-1价,得电子化合价降低的反应物是氧化剂,是电子化合价升高的反应物是还原剂,还原剂对应的产物是氧化产物;若1molP4参加反应转移电子的物质的量=1mol×4×(5-0)
易错点
电子转移的数目计算错误
正确答案
① 同主族元素,随着核电荷数增加,原子半径逐渐增大,金属性增强。② NiCl2 + 2e-= Ni +2Cl—
解析
①同一主族元素的原子,原子半径越大,金属活泼性越强,故钠比锂活泼
故答案为:同主族元素,随着核电荷数增加,原子半径逐渐增大,金属性增强
② ZEBRA电池的正极上发生得电子的还原反应,即NiCl2 + 2e-= Ni +2Cl—
故答案为:NiCl2 + 2e-= Ni +2Cl—
考查方向
解题思路
①同一主族元素的原子,原子半径越大,金属活泼性越强
②原电池的正极上发生得电子的还原反应
易错点
电极方程式书写中电荷不守恒
正确答案
阳极 N2O4+2HNO3﹣2e﹣=2H++2N2O5
解析
电解池中生成N2O5的电极发生氧化反应,N2O4被氧化,电极方程式为:N2O4+2HNO3﹣2e﹣=2H++2N2O5
故答案为N2O4+2HNO3﹣2e﹣=2H++2N2O5
考查方向
解题思路
电解池中生成N2O5的电极发生氧化反应,N2O4被氧化
易错点
电解池阴阳极判断失误
铁、钴(Co)、镍(Ni)是同族元素,都是较活泼的金属,它们的化合物在工业上有重要的应用.
36.草酸钴(CoC₂O₄)是一种难溶于水的浅粉红色粉末,通常用硫酸钴溶液和草酸铵溶液反应制得,写出该反应的离子方程式:
37.现将含0.5mol FeCl3的溶液和含0.5mol KSCN的溶液混合,混合后溶液体积为1L,已知溶液存在平衡:Fe3++SCN- Fe(SCN)2+(忽略其它过程)。平衡浓度c[Fe(SCN)2+]与温度T的关系如图1所示:则该反应△H 0(填“>”或“<”),温度为T1时,反应在5秒钟时达到平衡,平衡c[Fe(SCN)2+]=0.45mol /L,求达到平衡时的平均反应速率v(SCN-)= mol·L-1·S-1 ,该温度下的Fe3+的平衡转化率为 ,该温度下反应的平衡常数为 。
38.已知某溶液中,Co2+、Ni2+的浓度分别为0.60mol/L和1.2mol/L,取一定量的该溶液,向其中滴加NaOH溶液,当Co(OH)2开始沉淀时,溶液中
(已知Ksp[Co(OH)2]=6.0×10﹣15,Ksp[Ni(OH)2]=2.0×10﹣15)
39.古代铁器(埋藏在地下)在严重缺氧的环境中,仍然锈蚀严重(电化学腐蚀)。原因是一种叫做硫酸盐还原菌的细菌,能提供正极反应的催化剂,每48g
①写出该电化学腐蚀的正极反应的电极反应式:
②文物出土前,铁器表面的腐蚀产物可能有(写化学式)
正确答案
C₂O₄2— + Co2+ = CoC₂O₄↓
解析
硫酸钴溶液和草酸铵溶液发生复分解反应生成难容的草酸钴,根据原子守恒和电荷守恒,有C₂O₄2— + Co2+ = CoC₂O₄↓;
故答案为:C₂O₄2— + Co2+ = CoC₂O₄↓;
考查方向
解题思路
硫酸钴溶液和草酸铵溶液发生复分解反应生成难容的草酸钴,根据原子守恒和电荷守恒书写离子方程式
易错点
复分解反应书写方法未掌握
正确答案
< 0.09 90% 180 L·mol -1
解析
根据平衡移动原理可知,升高温度平衡向吸热的方向移动,据此图可知,升高温度c(Fe(SCN)2+)的值减小,所以△H<0,反应在5S钟时达到平衡,平衡时c(Fe(SCN)2+)=0.45mol/L,则达到平衡时的平均反应速率v(SCN-)= v(Fe(SCN)2+)=


故答案为:< 0.09 90% 180 L·mol -1
考查方向
解题思路
根据平衡移动原理可知,升高温度平衡向吸热的方向移动,据此可判断反应的△H;根据

易错点
不会使用三短法进行基本计算
正确答案
3.0
解析
Ksp[Co(OH)2]=6.0×10﹣15,Ksp[Ni(OH)2]=2.0×10﹣15,对于同种类型的沉淀Ksp越小,越难溶,则在低价氢氧化钠溶液的过程中,二价镍离子先沉淀,Ni2++2OH-=Ni(OH)2↓,当Co2+开始沉淀是,溶液中存在两个溶解平衡:Co(OH)2= Co2++2OH-,Ni(OH)2= Ni2++2OH-,根据Ksp[Co(OH)2]计算出此时溶液中氢氧根离子浓度


故答案为:3.0
[来源:学+科39.古代铁器(埋藏在地下)在严重缺氧的环境中,仍然锈蚀严重(电化学腐蚀)。原因是一种叫做硫酸盐还原菌的细菌,能提供正极反应的催化剂,每48gSO放电转移电子数为2.408×1024,该反应放出的能量供给细菌生长、繁殖之需。
①写出该电化学腐蚀的正极反应的电极反应式: 。
②文物出土前,铁器表面的腐蚀产物可能有(写化学式) 。
根据题意可知,正极:SO42-+8e-+ 4H2O=S2-+8OH- ,负极:Fe-2e-=Fe2+ ,两极产物相遇,生成Fe (OH)2 ; FeS。
故答案为:①SO+8e-+4H2O===S2-+8OH- ; ②Fe(OH)2,FeS
考查方向
解题思路
Ksp[Co(OH)2]=6.0×10﹣15,Ksp[Ni(OH)2]=2.0×10﹣15,对于同种类型的沉淀Ksp越小,越难溶,则在低价氢氧化钠溶液的过程中,二价镍离子先沉淀,Ni2++2OH-=Ni(OH)2↓,当Co2+开始沉淀是,溶液中存在两个溶解平衡:Co(OH)2= Co2++2OH-,Ni(OH)2= Ni2++2OH-,根据Ksp[Co(OH)2]计算出此时溶液中氢氧根离子浓度,则可计算出此时溶液中剩下的镍离子浓度,最终计算出
根据题意可知,正极:SO42-+8e-+ 4H2O=S2-+8OH- ,负极:Fe-2e-=Fe2+ ,两极产物相遇,生成Fe (OH)2 ; FeS。
易错点
不会利用溶度积进行基本计算
电化学腐蚀原理不明确
正确答案
①
解析
根据题意可知,正极:SO42-+8e-+ 4H2O=S2-+8OH-,负极:Fe-2e-=Fe2+,两极产物相遇,生成Fe(OH)2 ; FeS。
考查方向
原电池电极反应的书写
解题思路
根据题意可知,正极:SO42-+8e-+ 4H2O=S2-+8OH-,负极:Fe-2e-=Fe2+,两极产物相遇,生成Fe(OH)2 ; FeS。
易错点
电化学腐蚀原理不明确
13.用如图所示装置处理含NO3—的酸性工业废水,某电极反应式2NO3—+12H++10e-=N2+6H2O,则下列说法错误的是
正确答案
解析
A、A为阳极,氢氧根离子在阳极放电生成氧气,故A正确;
B、A为阳极,水电离出来的氢氧根离子在阳极放电生成氢离子,氢离子从质子交换膜左侧向右侧移动,故B正确;
C、阳极电极反应式为4OH--4e-=O2+2H2O,阴极电极反应式为2NO3-+12H++10e-=N2+6H2O,转移20mol电子时,阳极生成20mol氢离子,而阴极反应24mol氢离子,氢离子浓度减小,pH增大,故C错误;
D、据电极反应式,阳极电极反应式为4OH--4e-=O2+2H2O,阴极电极反应式为2NO3-+12H++10e-=N2+6H2O,电解池阴极生成5.6g N2,转移电子物质的量为:
故本题选择C
考查方向
解题思路
据电极反应式为2NO3-+12H++10e-=N2+6H2O,可知,该反应为还原反应,为阴极反应式,废水在B极反应,说明B为阴极;A为阳极,氢氧根离子在阳极放电生成氧气和氢离子,据电子守恒和原子守恒解答.
易错点
无法判断电解池阴阳极
知识点
扫码查看完整答案与解析