- 原电池和电解池的工作原理
- 共168题
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系。下列叙述错误的是
正确答案
解析
略
知识点
26.TiO2在工业生产和日常生活中有重要用途。
I.工业上用钛矿石(FeTiO3,含FeO、Al2O3、SiO2等杂质)经过下述反应制得:
其中,步骤②发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O。
(1)净化钛矿石时,是否需要除去杂质FeO?答:( )(填“需要”或“不需要”)。
(2)净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中发生反应的化学方程式。
答:( )。
II.TiO2可通过下述两种方法制备金属钛:
“方法一”是电解TiO2来获得Ti(同时产生O2):将处理过的TiO2作阴极,石墨为阳极,熔融CaCl2为电解液,用碳块作电解槽池。
(3)阴极反应的电极反应式为___________________________________。
(4)电解过程中需定期向电解槽池中加入碳块的原因是______________________。
“方法二”是先将TiO2与Cl2、C反应得到TiCl4,再用镁还原得到Ti。因下述反应难于发生:
TiO2 (s)+2Cl2 (g)
所以不能直接由 TiO2 和 Cl2 反应(即氯化反应)来制取TiCl4。当往氯化反应体系中加入碳后,碳与上述反应发生耦合,使得反应在高温条件下能顺利进行。
(5)已知:C(s)+O2 (g) = CO2 (g) ΔH=-394 kJ·mol-1。请填空:
TiO2 (s)+C (s)+2Cl2 (g) = TiCl4 (l)+CO2 (g) ΔH= ______________
(6)从化学平衡的角度解释:往氯化反应体系中加入碳时,氯化反应能顺利进行的原因。
答:____________________________________________。
正确答案
(1)不需要
(2)Al2O3+2NaOH=2NaAlO2+H2O ; SiO2+2NaOH=Na2SiO3+H2O
(3)TiO2+4e-=Ti+2O2-(或Ti4++4e-=Ti)
(4)碳单质会与阳极产生的氧气反应而不断减少
(5)-243 kJ·mol-1
(6)碳单质与氧气反应减小产物浓度使平衡向右移动,导致反应顺利进行
解析
解析已在路上飞奔,马上就到!
知识点
27.A、B、C三种强电解质,它们在水中电离出的离子为Na+ 、Ag+ 、NO3- 、SO42- 、 Cl-,在如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、 B、 C三种溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙烧杯中c电极质量增加了10.8克。常温下各烧杯中溶液的pH与电解时间t的关系如图所示。据此回答下列问题:
(1)M为电源的_______极(填写“正”或“负”),甲、乙两个烧杯中的电解质分别为_______、_______(填写化学式)。
(2)计算电极f上生成的气体为_______mol。
(3)写出乙烧杯中的电解反应方程式:__________________________________________。
(4)若电解后甲溶液的体积为10L,则该溶液的pH为___________ 。
(5)要使丙恢复到原来的状态,应加入适量的( )(填写化学式)。
正确答案
(1)负 ; NaCl 、AgNO3
(2)0.025mol
(3)4AgNO3+2H2O= 4Ag+O2+4HNO3
(4)12
(5) H2O
解析
解析已在路上飞奔,马上就到!
知识点
碳及其化合物在科技、社会生产、生活中有着广泛的应用。请按要求回答下列问题:
23.已知:2CH4(g)+3O2(g)=2CO(g)+4H2O(l) △H1=﹣1214.6 kJ/mol
2CO(g)+O2(g)=2CO2(g) △H2=﹣566 kJ/mol
请写出CH4燃烧热的热化学方程式:______________________________________。
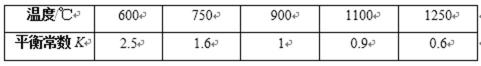
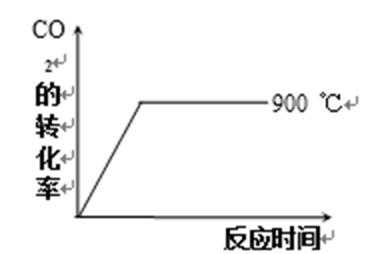
24.在不同温度下反应CO2(g)+H2(g) 
其他条件相同时,请在下图中画出750℃时CO2的转化率随时间变化的示意图。
25.以二甲醚(CH3OCH3)、空气、KOH溶液为原料可设计为燃料电池
①放电时,负极电极反应式:______________________________________。
②假设该燃料电池中盛有100.0 mL 3.0 mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为6.72 L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为_____________________________________________。
正确答案
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ/mol
考查方向
本题考查了热化学方程式的书写及燃烧热的概念
解题思路
根据燃烧热的定义,写方程式是可燃物只能是1mol:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=1/2△H1+1/2 △H2=-890.3 kJ/mol
易错点
忽略可燃物只能是1mol,即燃烧热的定义。
教师点评
本题考查了热化学方程式的书写,盖斯定律的应用及燃烧热的定义,在高考中出现频率高。
正确答案
考查方向
本题考查了化学平衡常数、化学平衡移动,化学反应速率,图像等知识点及学生分析图表获取信息的能力。
解题思路
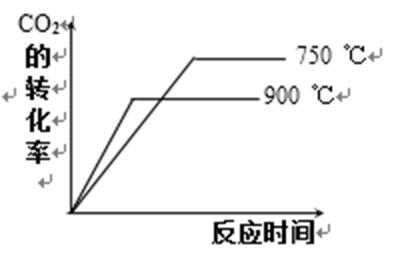
根据第一空,该反应为放热反应,750。C时,温度降低,速率减慢,达到平衡的时间变长,拐点延后,但平衡正移,二氧化碳转化率增大,平台高。
易错点
平衡移动和反应速率的影响结果混淆。
教师点评
本题考查了化学平衡常数、化学平衡移动,化学反应速率,图像等知识点及学生分析图表获取信息的能力。在高考中出现频率较高,但全国卷对该部分内容的考查难度稍大,本题难度较小。
正确答案
CH3OCH3-12e-+ 16OH-=2CO32-+11H2O(2分)
c(K+)>c (HCO3-)>c (CO32-)>c (OH-)>c( H+ ) (1分)
解析
由题意可知:
n(O2)=6.72/22.4 mol =0.3mol n(KOH)=0.3mol
n(e-)=4n(O2)=1.2mol 根据电子得失守恒:
n(CO2)=0.2mol
2KOH+ CO2= K 2 CO+ H 2 O
0.3 0.15 0.15
K 2 CO3+ H 2 O+ CO2=2KHCO3
0.05 0.05 0.1
即最终为n(K 2 CO3)=n(KHCO3)
碳酸钠水解程度大于碳酸氢钠,故得到答案结果。
考查方向
本题考查了燃料电池电极反应式书写、离子浓度大小的比较、计算等知识点。
解题思路
CH3OCH3-12e-+ 16OH-=2CO32-+11H2O
解题步骤:负极二甲醚放电,溶液呈碱性,碳元素的存在形态为CO32-,分析碳元素化合价,写出失去电子数,在根据电荷守恒配平OH-,根据原子守恒配平H2O
燃料电池都可以用这个模式来解题。
第二空见解析。
教师点评
本题考查了燃料电池电极反应式书写、离子浓度大小的比较、计算等知识点。难度较大,考查学生综合能力,在高考中出现频率中等。
5.模拟电渗析法将海水淡化的工作原理示意图如下。已知X、Y均为惰性电极,模拟海
水中富含Na+、Cl-、Ca2+、Mg2+、SO42-、HCO3-等离子。下列叙述中正确的是( )
正确答案
考查方向
本题考查了电解原理,电解电极反应是书写等知识。
解题思路
A.X为阴极,H离子放电,阳离子通过M补充阳离子,故为阳离子交换膜。根据放电顺序,Y极氯离子放电产生黄绿色气体。故A错
B.氢离子在x放电,Na+、Ca2+、Mg2+通过交换膜靠近x,氢氧化镁最先沉淀(根据溶解度),故B正确。
C.氢离子在x放电,,故电极反应式错误。
知识点
扫码查看完整答案与解析