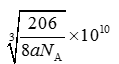- 物质结构
- 共214题
2.有关化学用语的表述正确的是
正确答案
解析
A.轨道表示式表示N2中的共用电子对,其中另一N原子的2p上的三个成单电子自旋方向要相反;
B.C.均错在“只能”上,还有很多其它双原子分子也符合;
D.的甲烷比例模型正确,是为正确选项。
考查方向
解题思路
准确理解轨道表示式、比例模型、球棍模型,及“只能”。
易错点
审题时忽视关键词“只能”等而错选B等。
知识点
1100℃时,在体积为5L的密闭容器中,发生可逆反应:Na2SO4(s)+4H2(g)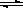
23.上述反应中涉及的非金属元素原子的半径从大到小的顺序为_____________,非金属性最强的元素原子的电子排布式_________________,其电子的自旋方向共有________种。
24.该反应中O、S属于同主族元素,比较它们的单质的氧化性 (用化学方程式表示),写出Na2O的电子式 ,比较Na2O和Na2S的熔点高低:Na2O Na2S。
25.上述平衡的平衡常数表达式K= 
26.能判断反应达到平衡状态的依据是 (填序号)A.混合气体的压强不变 B.混合气体的密度不变C.混合气体的
27.若初始时加入的Na2SO4为2.84g,10分钟后达到平衡时Na2SO4的转化率为45%,V(H2)= 。平衡后,向容器中充入1molH2,平衡向 (填“正反应方向”、“逆反应方向”或“不移动”),重新达到平衡后,与原平衡相比,H2的体积百分含量_____________(填“增大”、“减小”或“不变”)
正确答案
23..S>O>H ,1s22s22p4,2
解析
(23)方程式中出现的三种非金属元素分别为H、O、S,根据元素周期律电子层数越多半径越大,可知半径大小为S>O>H,非金属最强的为O元素,核外电子数为8,因此根据原子核外电子排布规则得知1s22s22p4,根据泡利原理可知自旋应该有2种.
考查方向
解题思路
准确把握结构决定性质,准确应用化学语言表达,应用元素周期律规律,化学平衡移动原理
易错点
位、枸、性三者关系,化学平衡原理
正确答案

解析
(24)根据同主族元素从上往下非金属性减弱即氧化性减弱的规律可知氧气的氧化性强于硫单质,因此2H2S+O2→2S+2H2O能充分说明和验证这一结论,电子式是一种表示物质结构的化学表述方式,常见的电子式书写需要注意离子化合物与共价键的书写,根据离子晶体熔沸点与离子半径有关的规律可知Na2O>Na2S。
考查方向
解题思路
准确把握结构决定性质,准确应用化学语言表达,应用元素周期律规律,化学平衡移动原理
易错点
位、枸、性三者关系,化学平衡原理
正确答案
25. [H2O]4/[H2]4,吸热
解析
(25)根据平衡常数的定义可知K=[H2O]4/[H2]4,根据K值只与温度有关,温度越高,K越大为吸热,K越小为放热可判断该反应为吸热反应。
考查方向
解题思路
准确把握结构决定性质,准确应用化学语言表达,应用元素周期律规律,化学平衡移动原理
易错点
位、枸、性三者关系,化学平衡原理
正确答案
26.BC
解析
(26)判断平衡的标志需要符合“变”到“不变”的物理特征以及建立平衡根本原因是正反应速率与逆反应速率相等,故选择BC。
考查方向
解题思路
准确把握结构决定性质,准确应用化学语言表达,应用元素周期律规律,化学平衡移动原理
易错点
位、枸、性三者关系,化学平衡原理
正确答案
27.7.2×10-4mol/(L·min),正反应方向,不变【考查方向】微粒半径大小的比较、原子核外电子排布、原子核外电子的运动状态、同一主族内元素性质递变规律、电子式、物质的结构与性质之间的关系、化学平衡常数的含义、化学平衡的影响因素、化学平衡状态的判断、化学平衡的计算
解析
(27)2.84g,10分钟后达到平衡时Na2SO4的转化率为45%能计算出硫酸钠消耗的物质的量从而得知氢气的物质的量,也就能得出氢气变化的浓度,据此计算V(H2)=7.2×10-4mol/(L·min),根据勒夏特列原理,增大反应物浓度将使得平衡向着正方向移动,由于该反应为气体前后气体体积相等的反应,依据等效平衡的特点,氢气的百分含量依然不变。
解题思路
准确把握结构决定性质,准确应用化学语言表达,应用元素周期律规律,化学平衡移动原理
易错点
位、枸、性三者关系,化学平衡原理
自然界中存在大量的金属元素,其中钠、镁、铁、铜等在工农业生产中有着广泛的应用。
24.请写出Fe的基态原子核外电子排布式 ▲ 。
25.金属A的原子只有3个电子层,为第一至第四电离能如下表:
则A原子的价电子排布式为 ▲ 。
26.NaCl和MgO都属离子化合物,NaCl的熔点为801.3°C,MgO的熔点高达2800°C。造成两种晶体熔点差距的主要原因是 ▲ 。
27.(NH4)2SO4、NH4NO3等颗粒物及扬尘等易引起雾霾,其中NH4+的空间结构型是 ▲
28.铜的化合物种类很多,右图是氢化亚铜的晶胞结构,已知晶胞的棱长为acm,则氢化亚铜密度的计算式为ρ= ▲ g·cm-3。(用NA表示阿伏加德罗常数)
29.合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(Ⅰ)溶液来吸收原料气体中的CO(Ac-代表CH3COO-),其反应是:[Cu(NH3)2]Ac+CO+NH3[Cu(NH3)3CO]Ac[醋酸羰基三氨合铜(Ⅰ)] ΔH<0
C、N、O三种元素的第一电离能由小到大的顺序为 ______ 。
配合物[Cu(NH3)3CO]Ac中心原子的配位数为 __________ 。
在一定条件下NH3与CO2能合成尿素[CO(NH2)2],尿素中C原子和N原子轨道的杂化类型分别为 ________ ;1mol尿素分子中,σ键的数目为 __________- NA。
正确答案
[Ar]3d64s2
解析
Fe是26号元素,其基态原子核外电子排布式按照构造原理可以写出是1S22S22P63S23P63d64S2。
考查方向
解题思路
Fe是26号元素,用构造原理就可以写出电子排布式。金属A的原子只有3个电子层,为第一至第四电离能在表中说明在失去第3个电子的时候需要的能量非常大,所以此元素很容易失去外层2个电子,且A有3个电子层,所以此元素是Mg。C、N、O是同周期元素,三种元素的第一电离能从左到右逐渐增大。配合物[Cu(NH3)3CO]Ac中心原子的配位体一般都是化合物,而此配合物中的化合物有两种,一个是NH3,一个是CO。NaCl和MgO都属离子化合物,NaCl的熔点为801.3°C,MgO的熔点高达2800°C。造成两种晶体熔点差距的主要原因是MgO晶体所含离子半径小,电荷数多,晶格能大。(NH4)2SO4、NH4NO3等颗粒物及扬尘等易引起雾霾,其中NH4+的空间结构型是正四面体,与NO3-互为等电子体要求的是分子,则必须符合等电子体的条件的分子才是正确答案,必须是4个原子,必须是元素最外层电子数为24个,最后利用公式来计算:ρV=N·M÷NA来计算即可。
易错点
对构造原理不熟悉,对Fe的原子序数陌生,不能正确写出其电子排布式,对电离能的概念和其周期性变化规律的判断失误,对配位化合物中配位体、配位数、中心原子的理解失误。对物质结构的分析利用VSEPR模型判断其杂化类型和共价键中的类型的判断的失误,对晶格能的概念理解有误,对物质空间构型和等电子体的概念记忆不清,对晶胞结构计算原子个数和原子半径计算能力较差。
正确答案
3s2
解析
金属A的原子只有3个电子层,为第一至第四电离能有表中说明在失去第3个电子的时候需要的能量非常大,所以此元素很容易失去外层2个电子,且A有3个电子层,所以此元素是Mg,则Mg原子的价电子排布式为3S2。
考查方向
解题思路
Fe是26号元素,用构造原理就可以写出电子排布式。金属A的原子只有3个电子层,为第一至第四电离能在表中说明在失去第3个电子的时候需要的能量非常大,所以此元素很容易失去外层2个电子,且A有3个电子层,所以此元素是Mg。C、N、O是同周期元素,三种元素的第一电离能从左到右逐渐增大。配合物[Cu(NH3)3CO]Ac中心原子的配位体一般都是化合物,而此配合物中的化合物有两种,一个是NH3,一个是CO。NaCl和MgO都属离子化合物,NaCl的熔点为801.3°C,MgO的熔点高达2800°C。造成两种晶体熔点差距的主要原因是MgO晶体所含离子半径小,电荷数多,晶格能大。(NH4)2SO4、NH4NO3等颗粒物及扬尘等易引起雾霾,其中NH4+的空间结构型是正四面体,与NO3-互为等电子体要求的是分子,则必须符合等电子体的条件的分子才是正确答案,必须是4个原子,必须是元素最外层电子数为24个,最后利用公式来计算:ρV=N·M÷NA来计算即可。
易错点
对构造原理不熟悉,对Fe的原子序数陌生,不能正确写出其电子排布式,对电离能的概念和其周期性变化规律的判断失误,对配位化合物中配位体、配位数、中心原子的理解失误。对物质结构的分析利用VSEPR模型判断其杂化类型和共价键中的类型的判断的失误,对晶格能的概念理解有误,对物质空间构型和等电子体的概念记忆不清,对晶胞结构计算原子个数和原子半径计算能力较差。
正确答案
MgO晶体所含离子半径小,电荷数多,晶格能大
解析
NaCl和MgO都属离子化合物,NaCl的熔点为801.3°C,MgO的熔点高达2800°C。造成两种晶体熔点差距的主要原因是MgO晶体所含离子半径小,电荷数多,晶格能大。
考查方向
解题思路
Fe是26号元素,用构造原理就可以写出电子排布式。金属A的原子只有3个电子层,为第一至第四电离能在表中说明在失去第3个电子的时候需要的能量非常大,所以此元素很容易失去外层2个电子,且A有3个电子层,所以此元素是Mg。C、N、O是同周期元素,三种元素的第一电离能从左到右逐渐增大。配合物[Cu(NH3)3CO]Ac中心原子的配位体一般都是化合物,而此配合物中的化合物有两种,一个是NH3,一个是CO。NaCl和MgO都属离子化合物,NaCl的熔点为801.3°C,MgO的熔点高达2800°C。造成两种晶体熔点差距的主要原因是MgO晶体所含离子半径小,电荷数多,晶格能大。(NH4)2SO4、NH4NO3等颗粒物及扬尘等易引起雾霾,其中NH4+的空间结构型是正四面体,与NO3-互为等电子体要求的是分子,则必须符合等电子体的条件的分子才是正确答案,必须是4个原子,必须是元素最外层电子数为24个,最后利用公式来计算:ρV=N·M÷NA来计算即可。
易错点
对构造原理不熟悉,对Fe的原子序数陌生,不能正确写出其电子排布式,对电离能的概念和其周期性变化规律的判断失误,对配位化合物中配位体、配位数、中心原子的理解失误。对物质结构的分析利用VSEPR模型判断其杂化类型和共价键中的类型的判断的失误,对晶格能的概念理解有误,对物质空间构型和等电子体的概念记忆不清,对晶胞结构计算原子个数和原子半径计算能力较差。
正确答案
正四面体SO3或者BF3(其它合理答案也给分)
解析
(NH4)2SO4、NH4NO3等颗粒物及扬尘等易引起雾霾,其中NH4+的空间结构型是正四面体,与NO3-互为等电子体分子数必须是4个原子和24个外层电子,所以其等电子体是SO3或者BF3。
考查方向
解题思路
Fe是26号元素,用构造原理就可以写出电子排布式。金属A的原子只有3个电子层,为第一至第四电离能在表中说明在失去第3个电子的时候需要的能量非常大,所以此元素很容易失去外层2个电子,且A有3个电子层,所以此元素是Mg。C、N、O是同周期元素,三种元素的第一电离能从左到右逐渐增大。配合物[Cu(NH3)3CO]Ac中心原子的配位体一般都是化合物,而此配合物中的化合物有两种,一个是NH3,一个是CO。NaCl和MgO都属离子化合物,NaCl的熔点为801.3°C,MgO的熔点高达2800°C。造成两种晶体熔点差距的主要原因是MgO晶体所含离子半径小,电荷数多,晶格能大。(NH4)2SO4、NH4NO3等颗粒物及扬尘等易引起雾霾,其中NH4+的空间结构型是正四面体,与NO3-互为等电子体要求的是分子,则必须符合等电子体的条件的分子才是正确答案,必须是4个原子,必须是元素最外层电子数为24个,最后利用公式来计算:ρV=N·M÷NA来计算即可。
易错点
对构造原理不熟悉,对Fe的原子序数陌生,不能正确写出其电子排布式,对电离能的概念和其周期性变化规律的判断失误,对配位化合物中配位体、配位数、中心原子的理解失误。对物质结构的分析利用VSEPR模型判断其杂化类型和共价键中的类型的判断的失误,对晶格能的概念理解有误,对物质空间构型和等电子体的概念记忆不清,对晶胞结构计算原子个数和原子半径计算能力较差。
正确答案
解析
铜的化合物种类很多,右图是氢化亚铜的晶胞结构,已知晶胞的棱长为acm,则氢化亚铜密度利用公式来计算:ρV=N·M÷NA,则ρ=(N·M)÷(V·NA ), 其中根据晶胞图可以计算出铜原子有8·1/8+6·1/2=4,H原子都在体内,有4个所以形成的化合物为CuH,这样的CuH共有4个,所以N=4,CuH的摩尔质量M=64+1=65g/mol,晶胞的棱长为a cm,则体积V=a3,所以套入公式可得密度为
考查方向
解题思路
Fe是26号元素,用构造原理就可以写出电子排布式。金属A的原子只有3个电子层,为第一至第四电离能在表中说明在失去第3个电子的时候需要的能量非常大,所以此元素很容易失去外层2个电子,且A有3个电子层,所以此元素是Mg。C、N、O是同周期元素,三种元素的第一电离能从左到右逐渐增大。配合物[Cu(NH3)3CO]Ac中心原子的配位体一般都是化合物,而此配合物中的化合物有两种,一个是NH3,一个是CO。NaCl和MgO都属离子化合物,NaCl的熔点为801.3°C,MgO的熔点高达2800°C。造成两种晶体熔点差距的主要原因是MgO晶体所含离子半径小,电荷数多,晶格能大。(NH4)2SO4、NH4NO3等颗粒物及扬尘等易引起雾霾,其中NH4+的空间结构型是正四面体,与NO3-互为等电子体要求的是分子,则必须符合等电子体的条件的分子才是正确答案,必须是4个原子,必须是元素最外层电子数为24个,最后利用公式来计算:ρV=N·M÷NA来计算即可。
易错点
对构造原理不熟悉,对Fe的原子序数陌生,不能正确写出其电子排布式,对电离能的概念和其周期性变化规律的判断失误,对配位化合物中配位体、配位数、中心原子的理解失误。对物质结构的分析利用VSEPR模型判断其杂化类型和共价键中的类型的判断的失误,对晶格能的概念理解有误,对物质空间构型和等电子体的概念记忆不清,对晶胞结构计算原子个数和原子半径计算能力较差。
正确答案
①C<O<N ②4 ③ sp2杂化、sp3杂化 7
解析
C、N、O三种元素的第一电离能同周期从左到右逐渐增大,所以由小到大的顺序为C<O<N。 配合物[Cu(NH3)3CO]Ac中心原子的配位数一般都是化合物的形式,此配合物中中心原子附近和化合物NH3有3个和CO有1个,所以其配位数为4个。尿素[CO(NH2)2]的结构式为
考查方向
根据构造原理正确写出基态原子的电子排布式书写的考查,根据电离能的概念的理解判断元素的原子序数和电离能的周期性变化规律的考查,对配位化合物中配位体、配位数、中心原子的考查。对物质结构的分析利用VSEPR模型判断其杂化类型和共价键中的类型的判断的考查,对晶格能的概念理解的考查,对物质空间构型和等电子体的考查,根据晶胞结构计算原子个数和原子半径计算能力的考查。
解题思路
Fe是26号元素,用构造原理就可以写出电子排布式。金属A的原子只有3个电子层,为第一至第四电离能在表中说明在失去第3个电子的时候需要的能量非常大,所以此元素很容易失去外层2个电子,且A有3个电子层,所以此元素是Mg。C、N、O是同周期元素,三种元素的第一电离能从左到右逐渐增大。配合物[Cu(NH3)3CO]Ac中心原子的配位体一般都是化合物,而此配合物中的化合物有两种,一个是NH3,一个是CO。NaCl和MgO都属离子化合物,NaCl的熔点为801.3°C,MgO的熔点高达2800°C。造成两种晶体熔点差距的主要原因是MgO晶体所含离子半径小,电荷数多,晶格能大。(NH4)2SO4、NH4NO3等颗粒物及扬尘等易引起雾霾,其中NH4+的空间结构型是正四面体,与NO3-互为等电子体要求的是分子,则必须符合等电子体的条件的分子才是正确答案,必须是4个原子,必须是元素最外层电子数为24个,最后利用公式来计算:ρV=N·M÷NA来计算即可。
易错点
对构造原理不熟悉,对Fe的原子序数陌生,不能正确写出其电子排布式,对电离能的概念和其周期性变化规律的判断失误,对配位化合物中配位体、配位数、中心原子的理解失误。对物质结构的分析利用VSEPR模型判断其杂化类型和共价键中的类型的判断的失误,对晶格能的概念理解有误,对物质空间构型和等电子体的概念记忆不清,对晶胞结构计算原子个数和原子半径计算能力较差。
2.核反应不仅能发电也能制造元素.2016 年初国际上确认,利用原子核间的撞击已制造出原子序数分别为113、115、117 和118 四种新元素,填补了目前元素周期表的空白,其中113 号元素与Al 元素处于同一主族.下列说法正确的是()
正确答案
解析
A。核反应发电是核能到电能
B原子的电子层数与周期数相同,最外层电子数等于主族序数,115号元素原子有七个电子层,应位于第七周期,最外层有5个电子,则应位于第VA族,
C.第七周期稀有气体原子序数=86+32=118,是第七周期最后一种元素,位于18列,117号元素处于第七周期第17列,故117号元素位于第七周期第ⅦA族
D.四种新元素都在第四周期
考查方向
解题思路
周期表中,原子的结构决定着元素在周期表中的位置,原子的电子层数与周期数相同,最外层电子数等于主族序数.熟记稀有气体的质子数(或碱金属族元素的质子数),这些元素分别是每个周期最后(或开始)一种元素,He-2,Ne-10,Ar-18,Kr-36,Xe-54,Rn-86,第七周期稀有气体原子序数=86+32=118,再根据原子序数之间的差值确定.
易错点
原子核外电子排布与在周期表中的位置
知识点
3.设NA为何伏加德罗常数的数值,下列说法不正确的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13.下列离子方程式书写正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.已知A(g)+B(g)
830℃时,向一个2 L的密闭容器中充入0.2mol的A和0.8mol的B,反应初始4 s内A的平均反应速率v(A)=0.005mol/(L·s)。下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.【化学—选修3:物质结构与性质】
A、B、C、D、E、F、G是前四周期(除稀有气体)原子序数依次增大的七种元素,A的原子核外电子只有一种运动状态;B、C的价电子层中未成对电子数都是2;B、C、D同周期;E核外的s、p能级的电子总数相筹;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满。回答下列问题:(相关问题用元素符号表示)
(1)写出E的基态原子的电子排布式________________________________。
(2)B与C可形成化合物BC和BC2,BC2属于__________(填“极性”、“非极性”)分子,1 mol BC含有π键为______________mol。
(3)由元素A、C、G组成的离子[G(A2C)4]2+在水溶液中显天蓝色,不考虑空间结构,[G(A2C)4]2+的结构可用示意图表示为__________(配位键用→标出)。
(4)测定A、D形成的化合物的相对分子质量时,实验测定值一般高于理论值的原因是_________,
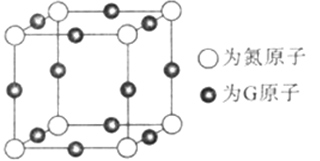
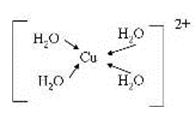
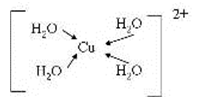
(5)由元素A、B、F组成的原子个数比9 : 3 : 1的一种物质,分子中含三个相同的原子团,其结构简式为____________________,分子中F原子的杂化方式为__________,该物质遇水爆炸,生成白色沉淀和无色气体,反应的化学方程式为____________________。 (6)G与氮元素形成的某种化合物的晶胞结构如图,则该化合物的化学式为__________,若晶体密度为a g·cm-3,列式计算G原子与氮原子最近的距离为____pm(不必计算出数值,阿伏加德罗常数的值用NA表示)。
正确答案
(1)1s22s22p63s2
(2)非极性 2
(3)
(4)HF分子之间存在氢键,形成缔合分子
(5)Al(CH3)3 sp2杂化
Al(CH3)3 +3H2O = Al(OH)3↓+3CH4↑
(6)Cu3N
解析
根据A的原子核外电子只有一种运动状态可知A为氢元素;B、C的价电子层中未成对电子数都是2且原子序数依次增大可知B、C分别为碳元素和氧元素;根据B、C、D同周期可知D为氟元素;E核外的s、p能级的电子总数相筹可知E的电子排布式为1s22s22p63s2 ,即为镁元素,由于原子序数依次增大且F与E同周期,第一电离能比E小可知F为半充满且第一电离反常铝元素;G的+1价离子(G+)的各层电子全充满可知G为铜元素;
(1)镁元素的基态原子的电子排布式为1s22s22p63s2 ;
(2)CO2分子中没有孤电子对,所以属于非极性分子,CO中含有碳氧三键,所以每个三键中含有2个π键,所以1 mol CO含有π键为2mol;
(3)[Cu(H2O)4]2+ 中含有配位键,Cu2+中有空轨道,H2O中O存在孤电子对,所以结构可用示意图表示为;
(4)由于HF分子之间存在氢键,形成缔合分子(HF)n,所以实验测定值一般高于理论值;
(5)由元素A、B、F组成的原子个数比9 : 3 : 1的一种物质的分子式为AlC3H9 ,由于分子中含三个相同的原子团,即为CH3,所以结构简式为 Al(CH3)3 ,CH3中碳原子的杂化方式为sp2杂化,该物质遇水爆炸,生成白色沉淀为Al(OH)3和无色气体CH4,反应方程式为 Al(CH3)3 +3H2O = Al(OH)3↓
+3CH4↑;
(6)Cu与氮元素形成的化合物的晶胞中,Cu原子为与晶胞的棱上,共有(1/4)×12=3,N 原子位于顶点上,共有(1/8)×8=1;所以则该化合物的化学式为Cu3N ;Cu原子与N原子最近的距离为棱长的
1/2,设距离为xcm,则根据密度计算公式ρ=m/V可知a =(206/NA)/(2x)3,所以x=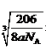
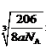
考查方向
解题思路
根据A的原子核外电子只有一种运动状态可知A为氢元素;
B、C的价电子层中未成对电子数都是2且原子序数依次增大可知B、C分别为碳元素和氧元素;
根据B、C、D同周期可知D为氟元素;
E核外的s、p能级的电子总数相筹可知E的电子排布式为1s22s22p63s2 ,即为镁元素,由于原子序数依次增大且F与E同周期,第一电离能比E小可知F为半充满且第一电离反常铝元素;G的+1价离子(G+)的各层电子全充满可知G为铜元素;
(1)镁元素的基态原子的电子排布式为1s22s22p63s2 ;
(2)CO2分子中没有孤电子对,所以属于非极性分子,CO中含有碳氧三键,所以每个CO中含有2个π键;
(3)[Cu(H2O)4]2+ 中含有配位键,Cu2+中有空轨道,H2O中O存在孤电子对;
(4)HF分子之间存在氢键,形成缔合分子(HF)n;
(5)由元素A、B、F组成的原子个数比9 : 3 : 1的一种物质的分子式为AlC3H9 ,由于分子中含三个相同的原子团,即为CH3,所以结构简式为 Al(CH3)3 ,CH3中碳原子的杂化方式为sp2杂化,该物质遇水爆炸,生成白色沉淀为Al(OH)3和无色气体CH4;
(6)Cu与氮元素形成的化合物的晶胞中,Cu原子为与晶胞的棱上,共有(1/4)×12=3,N 原子位于顶点上,共有(1/8)×8=1;Cu原子与N原子最近的距离为棱长的1/2;
易错点
由于不能有效掌握配位键的实质与题给信息的分析策略,所以不能准确判断出配位键;
空间想象能力薄弱,不能根据晶胞结构判断配位数,进而根据密度确定原子的距离。
知识点
7.下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
6.下列表述不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析