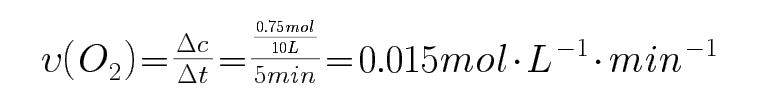- 物质结构
- 共214题
甲乙两同学分别对含+4价硫元素的物质性质进行了探究。
21.甲用右图装置进行实验(气密性已检验,加热和夹持装置已略去)。实验进行一段时间后,C、D中都出现明显的白色沉淀,经检验均为BaSO4。

进一步实验发现,出现白色沉淀的过程
中,D溶液中NO3-浓度几乎不变。
甲据此得出结论:D中出现白色沉淀的主要原因是 。
22.乙用如下实验对含+4价硫元素的物质性质继续进行探究。


正确答案
① Cu + 2H2SO4(
含+4价硫元素物质(SO2或H2SO3)被O2氧化生成SO42-
解析
①铜和浓硫酸加热发生反应生成硫酸铜、二氧化硫和水,反应的化学方程式为:Cu+2H2SO4(浓)
②为探究SO2在D中所发生的反应,甲进一步实验发现,出现白色沉淀的过程中,D溶液中NO3-浓度几乎不变,说明不是被NO3-氧化的而是被氧气氧化生成硫酸,甲据此得出结论:D中出现白色沉淀的主要原因是酸性溶液中二氧化硫会被氧气氧化生成硫酸,结合钡离子,也能生成硫酸钡沉淀
考查方向
本题考查了物质性质的实验探究
解题思路
①铜和浓硫酸加热发生反应生成硫酸铜、二氧化硫和水;
②出现白色沉淀的过程中,D溶液中NO3-浓度几乎不变说明不是被NO3-氧化的而是被氧气氧化生成硫酸,结合钡离子生成硫酸钡沉淀
易错点
D中出现白色沉淀,易考虑成NO3-在酸性条件下的氧化,但是溶液中的NO3-浓度基本不变成了限定条件,排除此因素,考虑其他因素影响
教师点评
本题考查了物质性质的实验探究,针对现象进行分析,题目难度较大
正确答案
① 2H+ + SO32- === SO2 + H2O (1分);2SO2 + O2 + 2Ba2+ + 2H2O === 2BaSO4↓ + 4H+
(或2H2SO3+O2+2Ba2+ === 2BaSO4↓+ 4H+) ② 含+4价硫元素物质可被O2和浓HNO3氧化③ 0.3 g 纯净Na2SO3和 1.17 g NaCl ii. NO3-的存在可以减慢溶液中+4价硫元素的氧化④ bd
解析
①取0.3g 纯净Na2SO3固体,向其中加入10mL 2mol•L-1 盐酸,再滴入4滴BaCl2溶液,产生无色气泡为二氧化硫气体,滴入BaCl2溶液后,开始无现象,4min后,溶液变浑浊,说明二氧化硫被空气中氧气氧化生成硫酸,结合钡离子生成硫酸钡白色沉淀,反应的离子方程式为:2H++SO32-═SO2+H2O,2SO2+O2+2Ba2++2H2O═2BaSO4↓+4H+或2H2SO3+O2+2Ba2+═2BaSO4↓+4H+
②由实验1说明空气中氧气也可以氧化+4价硫元素的化合物,实验2说明硝酸溶液中硝酸根离子对氧化反应起到减慢作用,出现沉淀时间长,实验3是浓硝酸能氧化+4价硫元素化合物生成硫酸根离子,出现沉淀快,对比可知氧气、浓硝酸都可以氧化二氧化硫
③探究Cl-和NO3-对其的影响,
i.实验2和4对比,乙获得推论:Cl-的存在可以加快溶液中+4价硫元素的氧化,实验4中需要提供和实验1中相同的氯离子实验探究,即需要0.01L×2mol/L=0.02mol,氯化钠的质量=0.02mol×58.5g/mol=1.17g,对比实验1判断出现沉淀的时间分析,取0.3g 纯净Na2SO3和1.17gNaCl固体,向其中加入10mL 2mol•L-1 HNO3,再滴入4滴BaCl2溶液,观察出现沉淀的时间;
ii.实验1和4对比,不同的是盐酸和硝酸,氯离子相同,出现沉淀的时间是盐酸溶液中快,乙获得推论是硝酸根离子减慢+4价硫的化合物的氧化,实验1和4对比,乙获得推论是:NO3-的存在可以减慢溶液中+4价硫元素的氧化;
④实验1可知,取0.3g 纯净Na2SO3固体,向其中加入10mL 2mol•L-1 盐酸,再滴入4滴BaCl2溶液,产生无色气泡;滴入BaCl2溶液后,开始无现象,4min后,溶液变浑浊,若含硫酸根离子,加入盐酸和氯化钡溶液会迅速生成白色沉淀,
实验2可知,取0.3g 纯净Na2SO3固体,向其中加入10mL 2mol•L-1 HNO3,再滴入4滴BaCl2溶液,产生无色气泡;滴入BaCl2溶液后,开始无现象,2h后,溶液变浑浊,加入硝酸和氯化钡溶液,+4价硫元素化合价被氧气的速率减慢,若有硫酸根离子会迅速生成沉淀
考查方向
本题考查实验方案的分析和设计
解题思路
①取0.3g 纯净Na2SO3固体,向其中加入10mL 2mol•L-1 盐酸,再滴入4滴BaCl2溶液,产生无色气泡为二氧化硫气体,滴入BaCl2溶液后,开始无现象,4min后,溶液变浑浊,说明二氧化硫被空气中氧气氧化生成硫酸,结合钡离子生成硫酸钡白色沉淀;
②由实验1、2、3对比可知氧气、浓硝酸都可以氧化二氧化硫;
③探究Cl-和NO3-对其的影响,
i.实验2和4对比,乙获得推论:Cl-的存在可以加快溶液中+4价硫元素的氧化,实验4中需要提供和实验1中相同的氯离子实验探究,即需要0.01L×2mol/L=0.02mol,据此和出现沉淀的时间分析;
ii.实验1和4对比,不同的是盐酸和硝酸,氯离子相同,出现沉淀的时间是盐酸溶液中快,乙获得推论是硝酸根离子减慢+4价硫的化合物的氧化;
④对比上述实验确定某溶液中含有SO42-的实验方案是加入盐酸和氯化钡溶液沉淀出现最快,加入硝酸和氯化钡溶液,+4价硫元素化合价被氧气的速率减慢,实验2可知,滴入BaCl2溶液后,开始无现象,2h后,溶液变浑浊,若有硫酸根离子会迅速生成沉淀.
易错点
实验现象的对比分析,确定影响反应速率的离子
教师点评
本题考查实验方案的分析和设计、主要是反应现象的不同原因分析判断,实验对比分析是探究实验的常用方法,注意信息提取和现象的理解应用,题目难度较大
大气污染越来越成为人们关注的问题,烟气中的NOx必须脱除(即脱硝)后才能排放,脱硝的方法有多种。
完成下列填空:
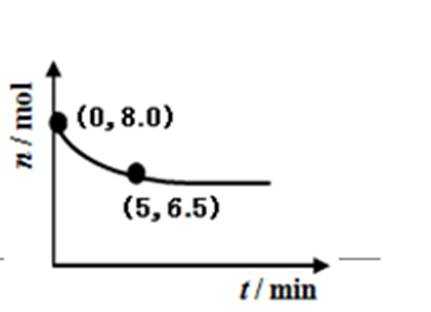
28.(直接脱硝)NO在催化剂作用下分解为氮气和氧气。在10 L密闭容器中,NO经直接脱硝反应时,其物质 ,的量变化如图所示。则0~5min内氧气的平均反应速率为________mol/(L·min)。
29.(臭氧脱硝)O3氧化NO 结合水洗可完全转化为HNO3,此时O3与NO的物质的量之比为_____。
30.(氨气脱硝)实验室制取纯净的氨气,除了氯化铵外,还需要_______、_______(填写试剂名称)。
不使用碳酸铵的原因是_______________________________(用化学方程式表示)。
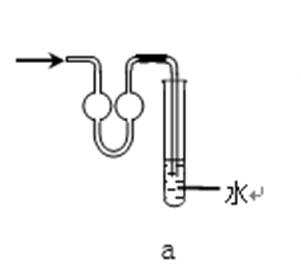
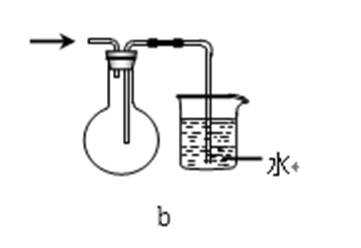
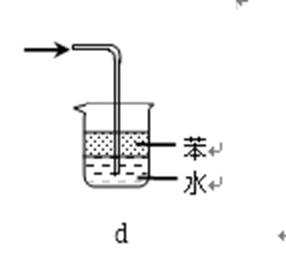
31.吸收氨气时,常使用防倒吸装置,下列装置不能达到此目的的是________。
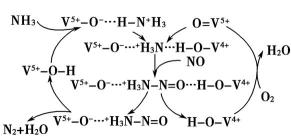
32.NH3脱除烟气中NO的原理如下图:
该脱硝原理中,NO最终转化为________(填化学式)和H2O。
当消耗1mol NH3 和0.25mol O2时,除去的NO在标准状况下的体积为______L。
正确答案
0.015
解析
在10L密闭容器中,根据图示,NO在5min内变化物质的量8.0mol-6.5mol=1.5mol,NO在催化剂作用下分解为氮气和氧气,2NO=O2+N2,生成氧气物质的量0.75mol,则0~5min内氧气的平均反应速率
考查方向
本题考查化学反应速率的计算
解题思路
图象得到NO物质的量变化,计算得到氧气物质的量变化,结合化学反应速率公式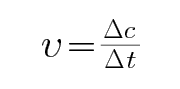
易错点
速率的计算公式是浓度的改变除以时间,易错用物质的量的改变除以时间
教师点评
本题考查化学反应速率的计算,在近几年的各省高考题中出现的频率较高,题目难度不大
正确答案
1: 2
解析
O3氧化NO 结合水洗可完全转化为HNO3,反应的化学方程式为:O3+2NO+H2O=2HNO3,此时O3与NO的物质的量之比为1:2
考查方向
本题考查氧化还原方程式的配平
解题思路
O3氧化NO 结合水洗可完全转化为HNO3,反应的化学方程式为:O3+2NO+H2O=2HNO3
易错点
化合价升降法配平,注意化合价的变化
教师点评
本题考查氧化还原方程式的配平,在近几年的各省高考题中出现的频率较高,侧重于学生能力的考查,题目难度中等
正确答案
熟(消)石灰;碱石灰 (NH4)2CO3 → 2NH3↑+ CO2↑+ 2H2O(2分)
解析
实验室利用固体氯化铵和氢氧化钙加热反应生成,氨气是碱性气体,干燥需要碱性干燥剂,实验室制取纯净的氨气,除了氯化铵外,还需要消(熟)石灰、碱石灰,不使用碳酸铵的原因是碳酸铵加热生成氨气同时会生成二氧化碳气体,反应的化学方程式为:(NH4)2CO3
考查方向
本题考查氨气的实验室制法
解题思路
实验室利用固体氯化铵和氢氧化钙加热反应生成,氨气是碱性气体,干燥需要碱性干燥剂,不使用碳酸铵的原因是碳酸铵加热生成氨气同时会生成二氧化碳气体;
易错点
实验室不能用直接加热氯化铵或碳酸铵的方法制取氨气
教师点评
本题考查氨气的实验室制法,在近几年的各省高考题中出现的频率较高,题目难度不大
正确答案
d
解析
装置abc中都有一个容积较大的仪器,它们能够吸收较多的液体,从而不会使倒吸的液体进入前面的装置,可以防止倒吸,d中导气管插入到水中,氨气极易溶于水,易引起倒吸,不能防倒吸,应是四氯化碳在下层,水在上层,防止倒吸且能吸收氨气
考查方向
本题考查气体的防倒吸装置
解题思路
氨气极易溶于水,在水溶液中易发生倒吸,根据气体压强的知识进行分析;
易错点
防倒吸原理:要有较大的缓冲空间或利用分层液体中的上层液体吸收
教师点评
本题考查气体的防倒吸装置,在近几年的各省高考题中出现的频率较高,题目难度中等
正确答案
N2(1分) 22.4 L(2分)
解析
①由图可知反应物为氧气、一氧化氮和氨气最终生成物为氮气和水,所以NO最终转化为N2和H2O;
②氧气、一氧化氮和氨气反应生成氮气和水,反应中氨气失去的电子的物质的量等于NO和氧气得到的电子总物质的量,2mol NH3转化为N2失去6mol电子,0.25mol O2得到1mol电子,则NO转化为N2得到的电子为2mol,所以NO的物质的量为1mol,其体积为22.4L;
考查方向
本题考查氧化还原反应及其计算
解题思路
①由图可知反应物为氧气、一氧化氮和氨气最终生成物为氮气和水;
②根据氨气失去的电子的物质的量等于NO和氧气得到的电子总物质的量计算
易错点
得失电子守恒的应用
教师点评
本题考查氧化还原反应及其计算,在近几年的各省高考题中出现的频率非常高,题目难度中等
下列反应在210℃时达到平衡:①PCl5(g)


23.氯原子核外有____种不同能级的电子,最外层上的电子云有____种不同的伸展方向
24.上述反应中有多种元素,请按照原子半径由大到小进行排序:__________________。
25.碳与其同主族的短周期元素相比较,二者的最高价氧化物的熔沸点差异较大,原因是_____________________________________________________________________。
26.下列不可用于比较氧和碳非金属性强弱的是_______
27.210℃时,K3=___________________(填计算结果)。210℃时,向一个容积3L的恒温恒容的密闭容器中加入6molPCl5(g),达到平衡后,PCl5(g)的平衡转化率为__________;若达到平衡所需的时间为a分钟,则从反应开始至达到平衡的过程中,C12(g)的平均反应速率为___________。
28.若向一个绝热恒容的密闭容器中加入1molC12(g)和1molCO(g),达到平衡后,再
加入C12(g),则平衡②将____移动(填“向左”. “向右”.或者“不”), K2将会_____(填“增大”.“减小”或“不变”)。
正确答案
5、4
解析
根据氯原子在元素周期表的位置可知,氯为17号元素,其电子排布为1S22S22P63S23P5可知氯原子核外有_5_种不同能级的电子,最外层上的电子云有__4__种不同的伸展方向
考查方向
根据氯原子在元素周表与原子结构
解题思路
根据氯原子在元素周期表的位置可知,氯为17号元素,其电子排布为1S22S22P63S23P5可知氯原子核外有_5_种不同能级的电子,最外层上的电子云有__4__种不同的伸展方向
易错点
电子排布为1S22S22P63S23P5与氯原子核外有_5_种不同能级的电子,最外层上的电子云有__4__种不同的伸展方向
教师点评
本题主要考查原子结构知识,内容较为基础,属于基础题
正确答案
P>Cl>C>O
解析
根据氯原子在元素周期表的位置和元素周期律可知,同一周期从左到右依次减小,从上到下依次增大,同时电子层数越多半径越大、电子层相同,核电荷数越大半径越小
考查方向
根据氯原子在元素周期表的位置和元素周期律
解题思路
根据氯原子在元素周期表的位置和元素周期律可知,同一周期从左到右依次减小,从上到下依次增大,同时电子层数越多半径越大、电子层相同,核电荷数越大半径越小
易错点
C与P的半径比较
教师点评
本题主要考查原子结构与元素周期律知识,内容较为基础,属于基础题
正确答案
二氧化碳晶体是分子晶体,二氧化硅是原子晶体,所以后者熔沸点远高于前者
解析
氧化碳晶体是分子晶体,二氧化硅是原子晶体,所以原子晶体熔沸点远高于分子晶体
考查方向
晶体结构与性质
解题思路
二氧化碳晶体是分子晶体,二氧化硅是原子晶体,所以原子晶体熔沸点远高于分子晶体
易错点
晶体结构的判断
教师点评
本题考查晶体结构与性质
正确答案
解析
回顾判断元素非金属性强弱的规律有1.单质与氢气化合的难易2.最高价含氧酸的酸性3.气态氢化物的稳定性,4.元素周期律等根据规律可判断
考查方向
元素周期表与元素周期律
解题思路
回顾判断元素非金属性强弱的规律有1.单质与氢气化合的难易2.最高价含氧酸的酸性3.气态氢化物的稳定性,4.元素周期律等根据规律可判断
易错点
对元素周期律知识的掌握不清楚
教师点评
本题考查元素周期律中非金属性的强弱判断方法,中等难度
正确答案
K3=2X10-5 ,50%, 1/a mol/(L.min)
解析
根据平衡常数的计算式可知,K1=C(Cl2)C(PCl3)/C(PCl5), K2=C(COCl2)/C(Cl2)C(CO),K3=C(CO)C(Cl2)/C(COCl2),
所以k3=1/k2=2X10-5
考查方向
化学平衡相关知识
解题思路
根据平衡常数的计算式可知,K1=C(Cl2)C(PCl3)/C(PCl5), K2=C(COCl2)/C(Cl2)C(CO),K3=C(CO)C(Cl2)/C(COCl2),所以k3=1/k2=2X10-5
易错点
根据平衡常数的计算式的转化关系k3=1/k2=2X10-5
教师点评
本题考查化学平衡的计算属于中等难度题
正确答案
向右、减小
解析
根据勒夏特列原理可知,改变影响化学平衡的一个条件平衡向着减弱这种改变的方向进行,即加入氯气平衡向减少氯气的方向进行即向右移动,反应放热,体系温度升高,k减小
考查方向
化学平衡的移动
解题思路
根据勒夏特列原理可知,改变影响化学平衡的一个条件平衡向着减弱这种改变的方向进行,即加入氯气平衡向减少氯气的方向进行即向右移动,反应放热,体系温度升高,k减小
易错点
k值的判断,绝热体系温度会发生变化,对k产生影响
教师点评
化学平衡移动的考查,基础题
12. X、Y、Z.、W、R为短周期元素,在周期表中位置如下,其中Z元素的原子最外层电子数是其内层电子数的3倍。下列说法正确的是
正确答案
解析
见解题思路。
考查方向
本题考查元素周期表及元素周期律相关知识。
解题思路
选项A:错误。根据Z元素的原子最外层电子数是其内层电子数的3倍,推断Z为氧元素;则X为碳元素。碳有金刚石、石墨等同素异形体,氧有氧气和臭氧等同素异形体。
选项B:正确。RCl3溶液为AlCl3溶液,Na2W溶液为Na2S溶液,二者混合后发生双水解,生成氢氧化铝白色沉淀和硫化氢气体。
选项C:错误。T元素为Ga元素,为金属元素。
选项D:错误。简单离子半径大小关系为:
S2->N3->O2->Al3+,因此正确的关系为:W>Y> Z>R。
易错点
D答案为离子半径大小的比较,如果不认真审题,容易看成原子大小比较;另外,虽然Al处于元素周期表的第三周期,但是形成离子的时候,与氧离子和氮离子的核外电子排布是相同的,由于核电荷数最大,因此三者中,Al3+的半径最小。
教师点评
本题考查了元素周期表和元素周期律的相关知识,在各省近几年的高考题中出现的概率非常高,常与同素异形体、粒子半径大小比较等知识点交汇命题。
知识点
氮族元素化合物在医药、纳米材料制备中应用广泛。
40.P元素的基态电子电子排布式为
41.白磷的分子式为P4,其结构如下图所示,科学家目前合成了 N4分子, N 原子的杂化轨道类型是 ,N—N—N 键的键角为 ;
42.N、P、As原子的第一电离能由大到小的顺序为 。
44.立方氮化硼晶体的结构如下图所示:N与As是同族元素,B与Ga是同族元素,立方砷化镓晶体与立方氮化硼晶体结构类似,两种晶体中熔点较高的是 ;立方砷化镓晶体的晶胞边长为a pm,则其密度为 g·cm-3 (用含a的式子表示,设NA为阿伏加德罗常数的值)。
正确答案
1s22s22p63s23p3 或Ne3s23p3
解析
P原子核外有15个电子,根据构造原理书写基态P原子核外电子排布式为1s22s22p63s23p3
故答案为:1s22s22p63s23p3
考查方向
解题思路
P原子核外有15个电子,根据构造原理书写基态P原子核外电子排布式
易错点
书写电子排布式的方法不掌握
正确答案
sp3 60°
解析
N4分子中每个N原子价层电子对个数是4且含有一对孤对电子对,根据价层电子对互斥理论判断N原子杂化方式为sp3;该分子结构和白琳分子结构相同,为正四面体结构,键角为60度。
考查方向
解题思路
N4分子中每个N原子价层电子对个数是4且含有一对孤对电子对,根据价层电子对互斥理论判断N原子杂化方式;该分子结构和白琳分子结构相同,为正四面体结构
易错点
杂化类型不会判断
正确答案
N>P>As
HNO3 NO3— V形
解析
同主族元素,元素第一电离能随着原子序数增大而减小,故第一电离能N>P>As
故答案为:N>P>As
[来源:学.科.网Z.X43.HNO3、HNO2是氮元素形成的含氧酸,酸性较强的是 ,酸根中没有孤对电子的是 ,NO2—空间构型是 。
同一非金属元素形成的含氧酸中,非羟基O原子个数越多该酸酸性越强,硝酸分子中非羟基氧原子个数大于亚硝酸,所以硝酸酸性较强,硝酸根离子中孤店子对个数=

故答案为HNO3 NO3— V形
考查方向
解题思路
同主族元素,元素第一电离能随着原子序数增大而减小;
同一非金属元素形成的含氧酸中,非羟基O原子个数越多该酸酸性越强,硝酸分子中非羟基氧原子个数大于亚硝酸,所以硝酸酸性较强,硝酸根离子中孤店子对个数=

易错点
第一电离能变化规律未掌握
不会通过计算发法推断出空间构型
正确答案
氮化硼(或BN) 5.8×1032/NA·a3
解析
立方砷化镓晶体与立方氮化硼晶体结构类似,均属于原子晶体,原子半径小,共价键越强,晶体熔点越高,故氮化硼熔点更高;晶胞中 As、Ga原子数目均为4,晶胞质量为
故答案为:5.8×1032/NA·a3
考查方向
解题思路
立方砷化镓晶体与立方氮化硼晶体结构类似,均属于原子晶体,原子半径小,共价键越强,晶体熔点越高,根据均摊法计算晶胞中As、Ga原子数目,表示出晶胞质量,根据密度共识进行计算
易错点
不会利用密度公式进行晶胞的基本计算
扫码查看完整答案与解析