- 物质结构
- 共214题
14.关于反应2HI(g) 
正确答案
解析
A.反应是吸热反应,反应物的总键能高于生成物的总键能,故A错误;
B.反应可逆反应不能进行彻底,1mol I2(g)中通入1mol H2(g),反应放热小于11kJ,故B错误;
C.等物质的量时,I2(g)具有的能量高于I2(l),故C错误;
D.平衡时分离出HI(g),平衡逆向进行,碘化氢浓度先减小后增大,所以反应速率先减小后增大,但比原来速率小,故D正确;
考查方向
化学反应中的能量变化,反应速率
解题思路
A.反应前后能量守恒,反应是吸热反应分析;
B.反应可逆反应不能进行彻底;
C.物质聚集状态气体能量高于液体;
D.平衡时分离出HI(g),平衡逆向进行,碘化氢浓度先减小后增大;
易错点
D项,平衡时分离出碘化氢,碘化氢浓度先减小, 平衡逆向移动的,碘化氢浓度又增大
教师点评
本题考查了化学反应能量变化,反应速率影响因素分析判断,题目难度中等
知识点
(1)中国古代四大发明之一——黑火药,它的爆炸反应为
2KNO3+3C+S
①除S外,上列元素的电负性从大到小依次为 。
②在生成物中,A的晶体类型为 ,含极性共价键的分子的中心原子轨道杂化类型为 。
③已知



(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为 ,
(3


[CrCln(H2O)6-n]x++xR-H→Rx[CrCln(H2O)6-n]x++xH+
交换出来的
将含0.0015 mol 

正确答案
(1)①

(2)
(3)
解析
(1)①钾为活泼金属,电负性比较小;C、N、O在同周期,非金属性逐渐增强,电负性也逐渐增大;②











(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,应该都属于元素Ⅷ,原子序数T比Q多2,可以确定T为




(3)中和生成的




知识点
7.常温下,向20mL0.1mol/L某酸HR溶液中滴加0.1mol/L氢氧化钠溶液,溶液的PH与氢氧化钠溶液体积V的关系如图所示。下列说法不正确的是
正确答案
解析
图象分析可知氢氧化钠溶液加入20ml反应生成NaR溶液,溶液PH大于7显碱性,为R-水解导致,HR为弱酸,
A、c点达到滴定终点,溶质为NaR,R-水解呈碱性,选择指示剂变色范围较近的酚酞,不用甲基橙四因为变色范围大,导致误差大,故A错误;
B、HR为弱酸,滴定前主要以分子形成存在,故B正确;
C、V=20 mL时,由于温度不变,水的离子积常数不变,c(H+)×c(OH-)=1×10-14mol2/L2,故C正确;
D、c点达到滴定终点,溶质为NaR,R-水解呈碱性,c(Na+)>c(R-)>c(OH-)>c(H+),故D正确;
故选A.
考查方向
酸碱中和滴定、电离平衡与溶液的pH专题
解题思路
图象分析可知氢氧化钠溶液加入20ml反应生成NaR溶液,溶液PH大于7显碱性,为R-水解导致,HR为弱酸,主要以分子形成存在,当加入氢氧化钠20mL,时,两者恰好反应生成NaR,由于温度不变,水的离子积常数不变,c点达到滴定终点,溶质为NaR,R-水解呈碱性,据此分析溶液中存在粒子浓度大小关系。
易错点
酸碱中和滴定指示剂的选择;酸碱混合后溶质的判断及离子浓度大小的比较。
教师点评
本题考查酸碱混合溶液定性判断,为高考常见题型,题目难度中等,试题侧重于学生的分析能力的考查,明确图象中酸碱混合后溶液中的溶质是解答本题的关键,抓住图象进行分析即可.
知识点
(1)依据第2周期元素第一电离能的变化规律,参照右图B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置。
(2)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:
2NH3+3F2 
①上述化学方程式中的5种物质所属的晶体类型有 (填序号)。
a。离子晶体 b。分子晶体 c,原子晶体 d。金属晶体
②基态铜原子的核外电子排布式为 。
(3)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:
①晶体Q中各种微粒间的作用力不涉及 (填序号)。
a.离子键
b.共价键
c.配位键
d.金属键
e.氢键
f.范德华力
②R中阳离子的空间构型为 ,阴离子的中心原子轨道采用 杂化。
(4)已知苯酚(

正确答案
见解析。
解析
(1)
(2)①a、b、d ②1s22s22p63s23p63d104s1或[Ar]3d104s1
(3)①a、d ②三角锥型 sp3
(4)< 
知识点
硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g)
11.下列说法中可以说明该反应已达到平衡状态的是________________a.体系内混合气体的密度保持不变 b.v(NO2)正=v(SO3)逆 c.容器内气体的总压强保持不
变 d.NO体积分数不再改变
12.某温度下,NO2(g)+SO2(g)


正确答案
b,d
解析
a.由于反应是气体体积不变的反应,且全部是气体,故体系内混合气体的密度一直保持不变,故不能作为平衡的标志,故a错误;
b.反应中v(NO2)正=v(SO3)正一直存在,而只有平衡时才有v(SO3)正=v(SO3)逆,故只有平衡时才有v(NO2)正=v(SO3)逆,故当v(NO2)正=v(SO3)逆时,反应达平衡,故b正确;
c.由于反应是气体体积不变的反应,故容器内气体的总物质的量一直不变,则总压强一直保持不变,故不能作为反应达平衡的标志,故c错误;
d.在反应未平衡前,NO的消耗和生成速率不同,故NO体积分数会改变,当NO的体积分数不变时,说明反应达平衡,故d正确.
考查方向
本题考查了化学平衡状态判断的能力
解题思路
a.由于反应是气体体积不变的反应,且全部是气体,故体系内混合气体的密度一直保持不变,故不能作为平衡的标志,故a错误;
b.反应中v(NO2)正=v(SO3)正一直存在,而只有平衡时才有v(SO3)正=v(SO3)逆,故只有平衡时才有v(NO2)正=v(SO3)逆,故当v(NO2)正=v(SO3)逆时,反应达平衡,故b正确;
c.由于反应是气体体积不变的反应,故容器内气体的总物质的量一直不变,则总压强一直保持不变,故不能作为反应达平衡的标志,故c错误;
d.在反应未平衡前,NO的消耗和生成速率不同,故NO体积分数会改变,当NO的体积分数不变时,说明反应达平衡,故d正确.
故选bd.
易错点
根据化学平衡状态的定义,化学反应达到平衡时,正逆反应速率相等,某一物质的物质的量浓度保持一定,这也是判断化学反应是否平衡的标志,常见的化学平衡状态的标志,除了定义标志之外,还有一些衍生标志。
教师点评
本题考查了化学平衡状态判断的能力,在近几年的各省高考题出现的频率较高。
正确答案
① 0.006mol/(L·min) (1分)② <(1分) a=c<b(1分)
解析
①根据反应中NO2(g)和SO2(g)的起始浓度分别为0.1mol/L,设在10min达到平衡时,NO2浓度的该变量为x,根据三段式可知:
NO2(g)+SO2(g)⇌SO3(g)+NO(g)
初始(mol/L):0.1 0.1 0 0
△C: x x x x
平衡: 0.1-x 0.1-x x x
根据平衡常数为

则平均速率v(NO2)=0.06mol/L10min=0.006mol/(L•min),故答案为:0.006mol/(L•min);
②由于容器体积相同,且反应为气体体积不变的反应,故按照等比加料,达到的是等效平衡,故甲和丙为等效平衡,即丙中所达的平衡状态和甲相同,而由于丙中反应物的浓度大于甲,故反应速率比甲快,到达平衡的时间比10min短;由于甲和丙为等效平衡,故甲、丙中SO2(g)的转化率相等,而乙相当于是向甲容器中加入NO2,据故SO2的转化率大于甲,故三个容器中的转化率的关系为a=c<b.故答案为:<;a=c<b.
考查方向
本题考查了化学反应平衡的知识点
解题思路
①根据反应中NO2(g)和SO2(g)的起始浓度分别为0.1mol/L,设在10min达到平衡时,NO2浓度的该变量为x,根据三段式可知:
NO2(g)+SO2(g)⇌SO3(g)+NO(g)
初始(mol/L):0.1 0.1 0 0
△C: x x x x
平衡: 0.1-x 0.1-x x x
根据平衡常数为

则平均速率v(NO2)=0.06mol/L10min=0.006mol/(L•min),故答案为:0.006mol/(L•min);
②由于容器体积相同,且反应为气体体积不变的反应,故按照等比加料,达到的是等效平衡,故甲和丙为等效平衡,即丙中所达的平衡状态和甲相同,而由于丙中反应物的浓度大于甲,故反应速率比甲快,到达平衡的时间比10min短;由于甲和丙为等效平衡,故甲、丙中SO2(g)的转化率相等,而乙相当于是向甲容器中加入NO2,据故SO2的转化率大于甲,故三个容器中的转化率的关系为a=c<b.故答案为:<;a=c<b.
易错点
根据化学平衡状态的定义,化学反应达到平衡时,正逆反应速率相等,某一物质的物质的量浓度保持一定,这也是判断化学反应是否平衡的标志,常见的化学平衡状态的标志,除了定义标志之外,还有一些衍生标志。
教师点评
本题考查了化学反应平衡的知识点,在近几年的各省高考题出现的频率非常高。
某实验组为研究“不同条件”对化学平衡的影响情况,进行了如下实验:一定条件下,向一个1L密闭容器中加入等物质的量的X、Y和一定量的Z三种气体,甲图表示发生反应后各物质浓度(c)随时间(t)的变化〔其中t0~t1阶段c(Y)、c(Z)未画出〕。乙图表示化学反应速率(v)随时间(t)的变化,四个阶段都只改变一种条件(催化剂、温度、浓度、压强,每次改变条件均不同),已知t3~t4阶段为使用催化剂。
回答下列问题:
16.若t1=5 min,则t0~t1阶段以Y浓度变化表示的反应速率为v(Y)= 。
17.在t2~t3阶段Y的物质的量减小,则此阶段开始时v正 v逆(填“>”、“=”或“<”)。
18.t4~t5阶段改变的条件为 ,该反应的平衡常数表达式为 。
19.t5~t6阶段容器内Z的物质的量共增加0.30 mol,在反应中热量变化总量为a kJ,写出该反应的热化学方程式 。在乙图Ⅰ~Ⅴ处平衡中,平衡常数最大的是 。
20.在相同条件下,若向该容器中只加入X、Y,反应也可以达到完全相同的平衡状态,则n(x)=________mol,n(Y)=__________mol达平衡时,X的转化率= 。
正确答案
0.016mol·L—1·min—1(2分)
考查方向
速率的计算
解题思路
V=△C/△t=(0.15-0.07)mol/L÷5min=0.16mol/(L˙min)
易错点
单位的书写
教师点评
该题考查化学反应速率的计算,属于基础题
正确答案
>
解析
在t2~t3阶段Y的物质的量减小,说明反应正向进行,则此阶段开始时v正>v逆(
考查方向
平衡的移动
解题思路
在t2~t3阶段Y的物质的量减小,说明反应正向进行,则此阶段开始时v正>v逆(
易错点
平衡移动方向的判断
教师点评
本题考查平衡移动方向的判断
正确答案
减小压强,(2分)c3(Z)/c(X)c2(Y)(2分)。
解析
t4~t5阶段改变的条件为减小压强 , 因为除改变催化剂外 只有对一反应前后气体系数和相等的反应,改变压强才可能使平衡不发生移动,而速率减小说明是减小压强,该反应的平衡常数表达式直接根据定义可得出为 K=c3(Z)/c(X)c2(Y)
考查方向
影响平衡的因素及平衡常数
解题思路
t4~t5阶段改变的条件为减小压强 , 因为除改变催化剂外 只有对一反应前后气体系数和相等的反应,改变压强才可能使平衡不发生移动,而速率减小说明是减小压强,该反应的平衡常数表达式直接根据定义可得出为 K=c3(Z)/c(X)c2(Y)
易错点
压强对速率和平衡的影响
教师点评
本题考查影响平衡和速率的因素的相互关系,中等难度
正确答案
X(g) +2Y(g) 3Z(g) △H= +10a kJ/mol(2分)Ⅴ(1分)。
解析
t4~t5阶段改变的条件为减小压强 , 因为除改变催化剂外 只有对一反应前后气体系数和相等的反应,改变压强才可能使平衡不发生移动,可以得出反应方程式为X(g) +2Y(g) =3Z(g) 根据t5~t6阶段容器内Z的物质的量共增加0.30 mol,在反应中热量变化总量为a kJ, △H= +10a kJ/mol
考查方向
化学反应与能量及平衡常数的影响因素
解题思路
t4~t5阶段改变的条件为减小压强 , 因为除改变催化剂外 只有对一反应前后气体系数和相等的反应,改变压强才可能使平衡不发生移动,可以得出反应方程式为X(g) +2Y(g) =3Z(g) 根据t5~t6阶段容器内Z的物质的量共增加0.30 mol,在反应中热量变化总量为a kJ, △H= +10a kJ/mol
易错点
热量与反应系数不对应,单位、以及焓变的符号“+”
教师点评
本题考查化学反应与能量和化学平衡的综合运用,属于中等难度题
正确答案
0.16 mol (1分)0.17 mol (1分)31.25%(2分)
解析
本题根据相同条件下平衡常数不变根据条件列出三段式进行计算,可得在相同条件下,若向该容器中只加入X、Y,反应也可以达到完全相同的平衡状态,则n(x)=___0.16 mol ,n(Y)=_____0.17 mol 达平衡时,X的转化率= 31.25%
考查方向
化学平衡的计算
解题思路
本题根据相同条件下平衡常数不变进行计算,
易错点
不会利用平衡常数进行计算
教师点评
本题考查化学平衡的计算,中等难度题
碳族元素包括C 、Si、Ge .Sn、Pb
(1)碳纳米管由单层或多层石墨层卷曲而成,其结构类似于石墨晶体,每个碳原子通过___________杂化与周围碳原子成键,多层碳纳米管的层与层之间靠___________结合在一起。
(2)CH4共用电子对偏向C,SiH4中偏向H,则C、Si、H的电负性由大到小的顺序为___________。
(3)用阶层电子对互斥理论推断SnBr2分子中Sn—Br键的键角__________120○ (填“>、<、=”)
(4)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞定点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心。该化合物化学式为____________,每个Ba2+与________个O2-配位。
正确答案
(1)sp2 范德华力
(2)C>H >Si
(3) <
(4)PbBaO3,12。
解析
(1)石墨的每个碳原子用sp2杂化轨道与邻近的三个碳原子以共价键结合,形成无限的六边形平面网状结构,每个碳原子还有一个与碳环平面垂直的未参与杂化的2p轨道,并含有一个未成对电子,这些平面网状结构再以范德华力结合形成层状结构。因碳纳米管结构与石墨类似,可得答案。
(2)共用电子对偏向电负性大的原子,故电负性:C>H >Si。
(3) SnBr2分子中,Sn原子的价层电子对数目是(4+2)/2=3,配位原子数为2,故Sn原子含有故对电子,SnBr2空间构型为V型,键角小于120°。
(4)每个晶胞含有Pb4+:8×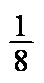
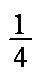
PbBaO3。Ba2+处于晶胞中心,只有1个,O2-处于晶胞棱边中心,共12个,
故每个Ba2+与12个O2-配位
知识点
氮族元素包括N、P、As、Sb和Bi五种元素。
(1)下列关于氮族元素的说法正确的是_________。
a. N2可用于填充霓虹灯。其发光原理是电子从能量较低的轨道跃迁到能量较高的轨道,以光的形式释放能量
b. P、Na、S三种元素的第一电离能由大到小的顺序是:P>S>Na
c. 基态As原子中,电子占据的最高能级为4d
d. Bi原子中最外层有5个能量相同的电子
(2)NH3在水中的溶解度比PH3大得多,其原因是_________。向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]SO4晶体。该晶体中含有的化学键除普通的共价键外,还有_________和_________。
(3)PC13分子中,Cl—P—Cl键的键角_________109°28′(填“>”“<”或“=”)。
(4)白磷(P4)是磷的一种单质,它属于分子晶体,其晶胞结构如图。己知该晶体的密度为pg·cm-3,晶胞的边长为acm,则阿伏加德罗常数为_________mol-1(用含p、a的式子表示)。
正确答案
(1)b
(2)NH3分子与水分子之间能够形成氢键;离子键;配位键
(3)<
(4)496/(ρa3)
解析
略。
知识点
A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大。B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族。B、C、D的最高价氧化物的水化物均能互相反应生成盐和水,D的原子半径是同周期原子中最小的。
根据以上信息,回答下列问题:
(1)上述A、B、C、D四种元素中第一电离能最小的是_________,电负性最大的是_________,原子半径由小到大的顺序为_________。(填相关元素的元素符号)
(2)A和D的氢化物中,沸点较高的是_________(填相关物质的分子式):其原因是_________。
(3)A和E可形成离子化合物,其晶胞结构如图所示,则每个晶胞中含阳离子的数目为_________,含阴离子的数目为_________,该离子化合物的化学式为_________。
正确答案
(1)Na;F;F < Cl < Al < Na
(2)HF,因为HF分子间存在氢键
(3)4;8;CaF2
解析
略。
知识点
周期表前四周期的元素a、b、c、d、e,原子序数依次增大。A的核外电子总数与其电子层数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同主族,e的最外层只有1个电子,但次外层有18个电子。回答下列问题:
(1)b、c、d中第一电离能最大的是 (填元素符号),e的价层电子轨道示意图为 。
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为 ;分子中既含有极性共价键,又含有非极性共价键的化合物是 (填化学式,写两种)。
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是 ;酸根呈三角锥结构的酸是 。(填化学式)
(4)c和e形成的一种离子化合物的晶体结构如图1,则e离子的电荷为 。
(5)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构,阳离子呈轴向狭长的八面体结构(如图2所示)。该化合物中阴离子为 ,阳离子中存在的化学键类型有 ;该化合物加热时首先失去的组分是 ,判断理由是 。
正确答案
(1)N
(2) 

(3)

(4) +1
(5)




解析
略
知识点
扫码查看完整答案与解析












