- 物质结构
- 共214题
3.硼的最高价含氧酸的化学式不可能是
正确答案
解析
B原子最外层电子数是3个,所以其最高化合价是+3价,然后根据化合物中正负化合价的代数和等于0可知不可能是H2BO3,故选项B符合题意。
考查方向
解题思路
元素的最高正价等于其最外层电子数。O、F除外。
易错点
不知道B最高化合价是+3价。
知识点
12.W、X、Y、Z是原子序数依次增大的短周期主族元素。W的气态氢化物的水溶液显碱性,X和Y同主族,Y元素的最高化合价为最低化合价的绝对值的3倍。下列说法错误的是
正确答案
解析
A选项,阴离子的还原性应该是S>O,所以该选项不能选;B选项氯离子是强酸阴离子,不会破坏水的电离平衡,因此该选项是错误的;C选项,高氯酸酸性大于硫酸,该选项不能选;D选项,由于O的非金属性大于N,所以氢化物热稳定性水大于氨气,所以该选项是错误的。
考查方向
元素周期表和元素周期律
解题思路
根据提议先推断出题给四种元素W、X、Y、Z依次为N、O、S、Cl,再根据元素周期律作答即可。
易错点
本题容易出现元素周期律的记忆混淆,如记阴离子还原性与元素非金属性之间的关系。
知识点
hero
正确答案
interview
正确答案
26.B、C、D、E、F是原子序数依次增大的短周期主族元素,B是短周期中金属性最强的元素,C是同周期中离子半径最小的元素,D元素的最高价氧化物对应水化物与B元素的最高价氧化物对应水化物反应的产物M是制备木材防火剂的原料,E的最外层电子数与内层电子数之比为3:5。请回答:
(1)D的原子结构示意图为( )。
(2)写出工业制F单质的化学方程式:( ) 。
(3)用电子式表示元素B与元素F形成的化合物:( )。
(4)B单质与氧气反应的产物与C的单质同时放入水中,产生两种无色气体,有关的化学方程式为( ) 、( )。
(5)写出M与盐酸反应的离子方程式:( )。
(6)工业上将干燥的F单质通入熔融的E单质中可制得化合物E2F2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,该反应的化学方程式为( ) 。
正确答案
(1)
(2)2NaCl+2H2O===2NaOH+H2↑+Cl2↑(条件:电解)
(3)
(4)2Na2O2 + 2H2O == 4NaOH + O2↑ 2Al+ 2NaOH + 2H2O === 2NaAlO2 +3H2↑
(5)SiO3 2- + 2H+ =
(6)2S2Cl2 + 2H2O == 3S + SO2↑+ 4HCl
解析
解析已在路上飞奔,马上就到!
知识点
25.C、N、O、Al、Si、Cu是常见的六种元素。
(1)Si位于元素周期表第____周期第_____族。
(2)N的基态原子核外电子排布式为_____;Cu的基态原子最外层有___个电子。
(3)用“>”或“<”填空:

0-t1时,原电池的负极是Al片,此时,正极的电极反应式是_____,溶液中的H+向___极移动,t1时,原电池中电子流动方向发生改变,其原因是______。
正确答案
(1)三;IVA
(2)
(3)> < > <
(4)


解析
解析已在路上飞奔,马上就到!
知识点
1.光电池(Solar cell)可用作计算器、人造卫星的动力,如图所示。下列分析正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其电子层数的
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27. A、B、C、D、E为五种短周期的元素,它们的原子序数依次增大,其中A与,D同主族,C与E同主族,只有D元素的单质是金属,D的离子与Ne具有相同的电子层结构,C的相对原子质量与E的核电荷数数值相同,B在周期表中与C相邻。据此回答:
(1)A元素是_______,B元素单质的电子式为_______。
(2)由A、B、C三种元素形成的化合物有多种,写出其中两种化合物的化学式_______。
(3)D与C两元素可形成两种化合物甲和乙,且甲和乙所含D、C原子数比分别为2:1和1:1。 则乙中所含化学键的类型是_______。
(4)A、C、D、E四种元素可形成一种化合物丙,丙既能与强碱反应又能与强酸反应。丙的化学式为_______。
(5)2011年l1月1日,“神舟八号”由改进型“长征二号”火箭顺利发射升空,2天后与此前发射的“天宫一号”目标飞行器进行了空间交会对接。在火箭推进器中装有强还原剂(分子组成为B2A4)和强氧化剂(分子组成为A2C2),当它们混合时,即产生B的单质和水蒸气,并放出大量热。已知0.4 mol液态B2A4与足量液态A2C2反应,生成B的单质和水蒸气,放出256. 7kJ的热量。写出该反应的热化学方程式。_____________。又已知

正确答案
解析
解析已在路上飞奔,马上就到!
知识点
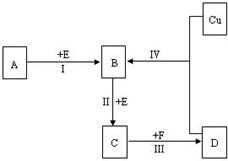
28.非金属元素X、Y位于短周期的相邻周期、相邻主族,它们的最高价氧化物的水化物均为强酸。根据下图转化关系(反应条件及部分产物已略去),回答下列问题:
(1)若A、B、C、D均为含X元素的化合物,且A的一个分子中只含有10个电子,则:
①A分子的空间构型为( )。
②反应I的化学方程式为( )。
(2)若A、B、C、D均为含Y元素的化合物,且A的摩尔质量为120g/mol,则:
①工业上实现反应I的化工设备的名称是_____________。
②在一个固定容积为5L的密闭容器中充入0.20 mol B和0.10mol E,半分钟后达到平衡,测得容器中含C 0.18mol,则v(E)=( )mol· L-1.min-1;若继续通入0.20mol B和0.10mol E,则平衡向( ) 移动,再次达到平衡后,( )mol<n(C)<( )mol。
③含Y元素的化合物Na2Y5和次氯酸钠溶液在强碱性环境中能发生反应,产物无沉淀,该反应的离子反应方程式为( )。
正确答案
(1)①三角锥形 ②4NH3+5O2
(2)①沸腾炉 ②0.036 正反应 0.36 0.40
③S52-+16ClO-+8OH-=5SO42-+16Cl-+4H2O
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析