- 蒸发和结晶、重结晶
- 共19题
实验室以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)为原料制取
(1)加入试剂X,调节溶液pH为碱性环境,以除去溶液中Al3+和Fe3+,滤渣的主要成分是___________。试剂X可以选择下列的________(填编号)。
A. CaO B. CaCO3 C. NH3·H2O D. Ba(OH)2
(2)操作II中进行蒸发浓缩时,除三角架、酒精灯外,还需要的仪器有_______________。
(3)由CaCl2制取CaO2的反应中,温度不宜太高的原因是_____________________________。
(4)用下列装置测定工业碳酸钙的质量分数
①按A—B—C—D顺序连接,然后从A装置通入空气,目的是_______________。
②装置D的作用为______________________。
③实验时,准确称取10.00g工业碳酸钙3份,进行3次测定,测得BaCO3沉淀的平均质量为17.73g,则样品中CaCO3的质量分数为_____。若无D装置,测量结果则_________。(填“偏大”、“偏小”、“无影响”)
④上述实验装置中,是否存在不合理之处?________(填“是”或“否”);若有不合理之处,需改进的是____________________________________________。
正确答案
(1)Fe(OH)3和Al(OH)3 ;AC
(2) 蒸发皿、玻璃棒(坩埚钳)
(3)防止温度过高H2O2发生分解
(4)①排尽装置中的二氧化碳
②防止空气中的CO2与Ba(OH)2溶液反应
③90%
④否;B、C装置中,为使分液漏斗中的液体顺利流出,用橡皮管将分液漏斗与锥形瓶、分液漏斗与集气瓶连接成连通装置。
解析
略
知识点
测定CuSO4∙nH2O的结晶水含量,方法是:称量样品→ 在坩埚中加热→ 冷却→ 称量无水盐。若用相同方法测试下列晶体中的结晶水含量,可行的是()
正确答案
解析
略
知识点
在盛有硫酸铜饱和溶液的恒温密闭容器中,投入一块形状不规则的硫酸铜晶体,放置数天后,发生的变化是
正确答案
解析
略
知识点
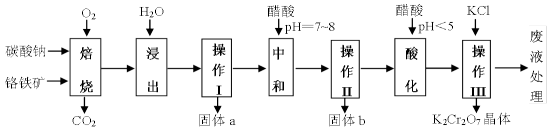
32.铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,下图所示是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的工艺流程。
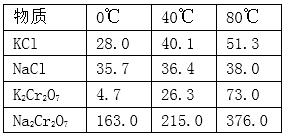
已知1:物质的溶解度(g/100g水)
已知2:
①焙烧时有Na2CrO4、 Fe2O3 、NaAlO2 等生成。
②Cr2O72- + H2O 
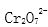
回答问题:
(1)“浸出”步骤中,为了提高浸出率,可采取的措施有( )(要求写一条)。
(2)固体b中主要含有 ( )(填写化学式)。
(3)要检测酸化操作中溶液的pH是否等于4.5,应该使用( )(填写仪器或用品名称)。
(4)酸化步骤用醋酸调节溶液的pH﹤5,其目的是( );不用盐酸调节溶液pH的原因是( )。
(5)操作III发生反应的化学方程式是( ),要得到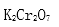
正确答案
(1)加热;或研磨;或搅拌;(2分)
(2)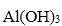
(3)pH计或精密pH试纸(2分)
(4)使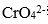
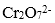
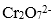
(5)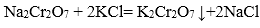
解析
解析已在路上飞奔,马上就到!
知识点
26.氯化铁是一种重要的化学试剂和化工原料,工业上以黄铁矿(主要成分为FeS2)为原料在制备硫酸的同时,利用其煅烧后炉渣的主要成分Fe2O3可制备氯化铁晶体(FeCl3·6H2O),其工艺流程如下(杂质不参与反应):
回答下列问题:
(1)高温煅烧时,黄铁矿要粉碎成细小的颗粒,其目的是 。
(2)黄铁矿高温煅烧时发生反应的化学方程式 。
(3)酸溶及后续过程中均需保持盐酸过量,其目的是 、 。
(4)系列操作包括:蒸发浓缩、 、 、洗涤等。蒸发与过滤时玻璃棒的作用分别是: 、 。
(5)取a g黄铁矿,按上述流程制得FeCl3·6H2O晶体,将该晶体溶于水,再将所得溶液蒸干、灼烧,得到b g固体产物(整个过程中的损耗忽略不计),黄铁矿的纯度为 (用含a、b的表达式表示)。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析