- 元素周期律的实质
- 共71题
11. X、Y、Z、R、W是原子序数依次增大的五种短周期元素。Y和R同主族,可组成共价化合物,Y和Z最外层电子数之和与W的最外层电子数相同,25℃时0.01 mol/LX和W形成化合物的水溶液pH为2。下列说法不正确的是( )
正确答案
解析
A.非金属性越强,氢化物的稳定性越强,氧元素的非金属性大于S,则水的稳定性强于H2S的稳定性,故A最强;
B.Y为O、Z为Na,可以形成Na2O、Na2O2,Na2O2中的阴离子为O22-,Na2O中的阴离子为O2-,阴阳离子的个数比都为1:2,故B正确;
C.同周期自左而右原子半径减小,同主族自上而下原子半径增大;电子层越多半径越大,X为H、Y为O、Z为Na、R为S、W为Cl,Na、S、Cl同属于第三周期元素,同周期自左而右原子半径减小,所以Na>S>Cl;H属于第一周期元素,半径最小,O属于第二周期元素,半径大于H小于第三周期元素,故原子半径由大到小排列的是:Z>R>W>Y>X,故C正确;
D.Y为O、Z为Na,W为Cl,形成NaClO4属于强酸强碱盐,溶液呈中性,故D错误。
故选D。
考查方向
解题思路
X、Y、Z、R、W是原子序数依次增大的五种短周期元素,Y和R同主族,Y处于第二周期,R处于第三周期,可组成共价化合物RY2和RY3,则Y为氧元素,R为硫元素,RY2为SO2、SO3,W的原子序数大于硫元素,故W为Cl元素,Y和Z最外层电子数之和与W的最外层电子数相同,则Z的最外层电子数为7-6=1,处于第ⅠA族,原子序数大于氧元素,故Z为Na元素,25℃时0.01mol•L-1X和W形成化合物的水溶液pH为2,则X为氢元素。
易错点
本题考查位置结构性质的相互关系应用,难度中等,关键是根据化学式判断元素的化合价推断元素可能存在的族。
知识点
11.X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、戊是由其中的两种或三种元素组成的化合物,丁是由Z元素形成的单质。已知:甲+丙→丁+己,甲+乙→戊+丁;25℃时0.01mol·L-1己溶液的pH为12。下列说法不正确的是( )
正确答案
解析
A.1.0L 0.1mol·L-1戊溶液中阴离子为CO32_,CO32_离子水解生成HCO3-离子和OH-离子,溶液中阴离子总的物质的量大于0.1mol,A说法正确;
B.Na2O2具有强氧化性,加入到酚酞试液中,溶液先变红后褪色,所以B说法正确;
C.NaH、碳酸钠、氢氧化钠均为离子化合物,所以C说法正确;
D.离子的电子层数数相同时,原子序数越大,离子半径越小,所以钠离子半径小于于氧离子半径,D错误;
考查方向
解题思路
根据0.01 mol•L-1己溶液的pH为12(25℃),己是一元强碱且其中的金属元素在短周期,甲+丙=丁+己,甲+乙=戊+丁;则“丁”是氧气,“己”是氢氧化钠,那么甲是Na2O2、乙是二氧化碳,丙是水,戊是碳酸钠,因此X为氢、Y为碳、Z为氧、W为钠元素;
A.1.0L 0.1mol·L-1戊溶液中阴离子为CO32_,由于碳酸根的水解,所以总的物质的量大于0.1mol
B.Na2O2具有强氧化性,加入到酚酞试液中,溶液先变红后褪色
C.NaH、碳酸钠、氢氧化钠均为离子化合物;
D.钠离子半径小于于氧离子半径;
易错点
不能准确提取有关元素结构和性质的信息,不能准确把握元素周期律以及有关元素化合物的性质。
知识点
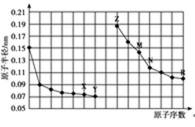
11.下图是部分短周期元素原子半径与原子序数的关系图。下列说法正确的是
正确答案
解析
A.金属性越强,最高价氧化物对应水化物的碱性越强:Z>M,A错误;
B.Y、R两种元素气态氢化物分别是HF、HCl,氟化氢分子之间形成氢键,Y、R两种元素气态氢化物的沸点:Y>R,B错误;
C.X为O元素、Z为Na元素、M为Al元素,三种元素的简单离子核外电子排布相同,核电荷数越大,离子半径越小,因此简单离子的半径:M<Z<X,C正确;
D.X、N两种元素组成的化合物是二氧化硅,二氧化硅与氢氟酸反应,D错误。
故选C。
考查方向
解题思路
由图可知:X为O元素;Y为F元素;Z为Na元素;M为Al元素;N为Si元素;R为Cl元素,据此作答:
易错点
本题解题的关键是推断出各元素的名称,据此作答,本题较为简单。
知识点
10.元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是 ( )
正确答案
解析
A.阳离子原子序数=核外电子数+电荷数,阴离子原子序数=核外电子数-电荷数,所以若X+和Y2-的核外电子层结构相同,则原子序数:X>Y,故A正确;
B.元素的非金属与元素最高价氧化物对应水化物的酸性强弱有关,与氢化物水溶液的酸性无关,故B错误;
C.在金属和非金属性元素的交界处的单质能作半导体材料,硅、锗都位于金属与非金属的交界处,都可以做半导体材料,故C正确;
D.同周期元素从左到右,元素的金属性逐渐减弱,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,故D正确。
故选B。
考查方向
解题思路
A.X+和Y2-的核外电子层结构相同,阳离子原子序数较大;
B.元素的非金属与元素最高价氧化物对应水化物的酸性强弱有关,与氢化物水溶液的酸性无关.
C.在金属和非金属性元素的交界处的单质能作半导体材料;
D.同周期元素自左而右金属性减弱,金属性Cs>Ba,金属性越强最高价氧化物对应水化物的碱性越强,故碱性CsOH>Ba(OH)2;
易错点
本题涉及元素周期律中非金属性和金属性强弱的判断、原子序数的判断等知识点,根据元素在周期表中的位置结合元素周期律来解答,熟记元素周期律内容,题目难度不大。
知识点
11. W、X、Y、Z是四种原子序数依次增大的短周期主族元素。W元素的最高正化合价与最低负化合价的代数和为0,X元素原子的电子层数是最外层电子数的3倍,Y元素原子M层上的电子数为6。则下列说法正确的是
正确答案
解析
A.原子半径:S > Cl > O,错误;
B.简单阴离子还原性:S2- > Cl-,错误;
C.最高价氧化物对应水化物的酸性:HClO4 > H2SO4,正确;
D.C与Cl形成的化合物可能是CCl4,CCl3,CCl2,CCl,不一定是易溶于水的气体,错误;故答案为C。
考查方向
本题主要考查了原子结构与元素周期律的关系;硫及其化合物氯及其化合物;碳、硅及其化合物元素周期律。
解题思路
本题考查了原子结构和元素周期律知识,熟悉元素周期表结构及原子结构是解本题关键,再结合元素周期律分析解答,正确推断元素即可解答,题目难度中等。W元素的最高正化合价与最低负化合价的代数和为0,则W为C或者Si,X元素原子的电子层数是最外层电子数的3倍,则X为O或S,Y元素原子M层上的电子数为6,则Y为S,又因为W、X、Y、Z是四种原子序数依次增大的短周期主族元素,则W为C,X为O,Y为S,Z为Cl;
易错点
1、原子结构与元素周期律的关系。
2、短周期元素原子电子层数与阳离子特点,推导简单阴离子还原性。
知识点
扫码查看完整答案与解析