- 元素周期律的实质
- 共71题
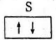
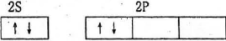
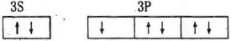
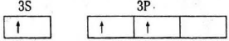
3.轨道表示式是表示原子核外电子运动状态的一种化学用语,下列有关原子的最外层的轨道表示式正确的是
正确答案
解析
A.铍原子最外层应该是2S,故错误。
B.2p能级层上的电子排布违反了洪特规则,同一能级总是先独自占据一个能级轨道。
C.正确。
D.根据能量最低原理,3s轨道低于3p轨道,所以电子先排满3s轨道,故错误
考查方向
解题思路
准确应用构造原理、洪特规则、泡利不相容原理
易错点
构造原理、洪特规则
知识点
8. a、b、c、d为短周期元素,a的M电子层有1个电子,b的最外层电子数为内层电子数的2倍,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c。下列叙述错误的是
正确答案
解析
根据a的M电子层有1个电子可知a元素为金属钠;b的最外层电子数为内层电子数的2倍可知b元素为碳元素;c的最高化合价为最低化合价绝对值的3倍可是c元素为硫元素;c与d同周期,d的原子半径小于c可是d元素为氯元素。综上所述D错误
考查方向
解题思路
根据原子结构以及元素周期表的、元素周期律的相关规律推断元素种类
易错点
元素种类的确定
知识点
2.下列化学用语正确的是
正确答案
解析
A.丙烯的实验式 CH2
B.正确
C.CO2的电子式
D.中子数为18的氯原子符号
考查方向
解题思路
认真读清题目要求,熟练掌握化学用语。
易错点
有机物分子式、实验式、结构简式等易混淆,CO2的电子式易错
知识点
12.4种短周期元素X、Y、Z、W的原子序数依次增大,依据表中信息判断,下列说法不正确的是
正确答案
解析
Na2O2中就有离子键和共价键,所以C错了。
考查方向
解题思路
四种元素0 Na Al S的原子结构,分析化学反应
易错点
化学反应小推断
知识点
3.现有X、Y、Z、M四种短周期元素,X、Y位于同主族,Z、M位于同主族,Y、Z位于同周期,X与Z、M都不在同一周期,Z的核电荷数是M的2倍。下列说法不正确的是()
正确答案
解析
短周期元素X、Y、Z、M,X、Y位于同主族,Z、M位于同主族,Y、Z位于同周期,X与Z、M都不在同一周期,则X是H元素,Z的核电荷数是M的2倍且Z、M位于同主族,所以Z是S元素、M是O元素,因为Y、Z位于同周期,所以Y是Na元素,即X、Y、Z、M分别是H、Na、S、O元素.
A.原子失电子能力越强,其简单阳离子得电子能力越弱,Na失电子能力大于H,所以得电子能力:H+>Na+,即简单阳离子的氧化性:Y<X;
B.非金属的金属性越强,其气态氢化物越稳定,非金属性M>Z,所以气态氢化物的稳定性:Z<M;
C.电子层数越多,其离子半径越大,电子层结构相同的离子,离子半径随着原子序数的增大而减小,S2-电子层数最多,所以其离子半径最大,Na+半径小于O2-,所以这三种离子半径大小顺序是Z>M>Y;
D.酸或碱抑制水电离,含有弱离子的盐促进水电离,等浓度的H2S与Na2S的溶液中,硫化氢抑制水电离,硫化钠促进水电离,所以水的电离程度:X2Z<Y2Z。
考查方向
解题思路
短周期元素X、Y、Z、M,X、Y位于同主族,Z、M位于同主族,Y、Z位于同周期,X与Z、M都不在同一周期,则X是H元素,Z的核电荷数是M的2倍且Z、M位于同主族,所以Z是S元素、M是O元素,因为Y、Z位于同周期,所以Y是Na元素。
A.原子失电子能力越强,其简单阳离子得电子能力越弱;
B.非金属的金属性越强,其气态氢化物越稳定;
C.电子层数越多,其离子半径越大,电子层结构相同的离子,离子半径随着原子序数的增大而减小;
D.酸或碱抑制水电离,含有弱离子的盐促进水电离.
易错点
本题考查了元素位置结构性质相互关系及应用,解答此题时要熟悉元素周期表的结构及原子之间的关系,再结合元素周期律来分析解答,知道哪些物质促进水电离、哪些物质抑制水电离,同时考查学生灵活运用知识能力。
知识点
扫码查看完整答案与解析