- 氯气的实验室制法
- 共24题
11.二氧化氯(ClO2)是一种黄绿色易溶于水的气体,常用作饮用水的消毒剂。实验室通过如下过程制备二氧化氯。
下列说法正确的是
正确答案
解析
A答案中的离子反应式中电荷不守恒,所以A错;B中大量存在Cl-和OH-的原因在于溶液X前的反应物中存在Cl元素,但生成物种无Cl元素,反应物中没有H元素,但后面产生了NH3,有了H元素,证明水中的H参与反应,同时导致OH-会增多,所以B正确;C答案中的食盐水不仅仅要除去NH3,而且也会除去ClO2,因为两者是易溶入水的物质,所以C错;题中NaClO2 反应后成为ClO2,化合价升高做还原剂,想要除去NaClO2 需要加入氧化剂即可,明矾中各元素的化合价不变,不能除去NaClO2,所以D错
考查方向
解题思路
电解时Cl元素的反应变化过程,分清溶液中的阴阳离子,由最终生成的气体和溶液中Cl元素的化合价变化推断其所发生的反应
易错点
对图示中的流程分析不清,及每个步骤中的参与的物质的转化理解有误,对氧化还原反应中的的电子转移情况不清楚。
知识点
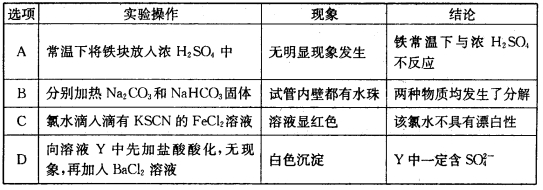
13.下列实验操作、现象和结论均正确的是
正确答案
D
解析
A.常温下,将铁块放入浓硫酸中,无明显现象,因为铁在浓硫酸中发生钝化现象,发生了化学反应,A错误;
B.碳酸钠加热不易分解,即使分解,也不会生成水,B错误;
C.氯水滴入含有KSCN的FeCl2溶液,氯水将亚铁离子氧化成三价铁离子,溶液变红色,显示了氯水的氧化性,不是漂白性,C错误;
D.向溶液Y中先加盐酸酸化,无现象,排除了银离子、碳酸根离子、亚硫酸根离子的干扰,再加入氯化钡溶液,产生白色沉淀,Y一定含硫酸根离子,D正确。
故选D。
考查方向
解题思路
A.常温下,将铁块放入浓硫酸中,无明显现象,因为铁在浓硫酸中发生钝化现象,发生了化学反应;
B.碳酸钠加热不易分解,即使分解,也不会生成水;
C.氯水滴入含有KSCN的FeCl2溶液,氯水将亚铁离子氧化成三价铁离子,溶液变红色,显示了氯水的氧化性,不是漂白性;
D.向溶液Y中先加盐酸酸化,无现象,排除了银离子、碳酸根离子、亚硫酸根离子的干扰。
易错点
本题考查化学实验方案的评价,为高频考点,把握物质的性质及发生的反应为解答的关键,涉及物质的检验、硝酸的性质、氧化还原反应等,综合性较强,题目难度不大。
知识点
10.某同学用下列装置制备并检验Cl2的性质。下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.氯气是一种重要的化工原料。
(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是( )。
(2)资料显示:
①在该实验中,甲部分的装置是( )(填字母);指出a中m仪器的名称( )。

②乙装置中FeCl2溶液Cl2反应的离子方程式是( )。证明FeCl2与Cl2发生了氧化还原反应的实验方法是(填加试剂的名称、至少填二种)方法( )、( );
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、清毒的物质。已知碳酸的酸性强于次氯酸,则丙中反应的化学方程式是( );
(3)为测定漂白粉中Ca(ClO)2的质量分数,该小组将2.0g漂白粉配制成250mL溶液,取出25mL并向其中依次加入过量稀H2SO4、过量KI溶液,完全反应后,再滴入

正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28、下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。
⑴制备氯气选用的药品为:漂粉精固体和浓盐酸,相关的化学反应方程式为:
__________________________________________________________________。
⑵装置B中饱和食盐水的作用是_______________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象______________________________。
⑶装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入_______。
⑷设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为______色,说明氯的非金属性大于溴。
⑸打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是_____________。
⑹有人提出,装置F中可改用足量的NaHSO3溶液吸收余氯,试写出相应的离子反应方程式___________________,判断改用NaHSO3溶液是否可行______(填“是”或“否”)。
正确答案
⑴Ca(ClO)2 + 4HCl(浓)→ CaCl2 + 2Cl2 ↑+ 2H2O
⑵除去Cl2中的HCl;B中长颈漏斗中液面上升,形成水柱;
⑶d ;
⑷黄;
⑸E中溶液分为两层,上层(苯层)为紫红色;
⑹ HSO3— + Cl2 + H2O → SO42— + 2Cl— + 3H+(或4HSO3— + Cl2 → SO42— + 2Cl— + 3SO2 + 2H2O,2分);否
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析