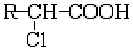- 有机物的推断
- 共316题
请考生从给出的3道化学题中任选一题做答。
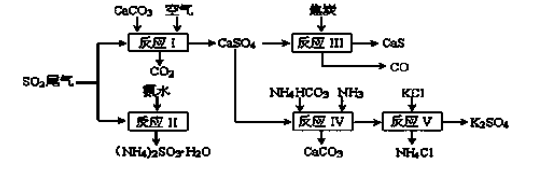
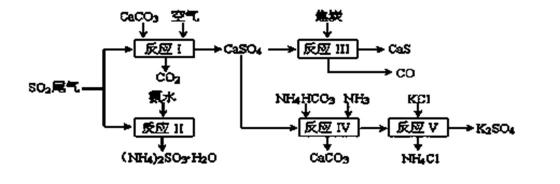
36.以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:
(1)写出反应Ⅰ的化学方程式 ( ) 。
(2)生产中,向反应II中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是
( ) 。
(3)下列有关说法正确的是( ) 。
a.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
b.反应III中氧化剂与还原剂的物质的量之比为4︰1
c.反应IV需控制在60~70℃,目的之一是减少碳酸氢铵的分解
d.反应V中的副产物氯化铵可用作氮肥
(4)反应Ⅴ在25℃、40%乙二醇溶液中进行,不断有硫酸钾晶体从溶液中析出,硫酸钾的产率会超过90%,选用40%乙二醇溶液的原因是( )。
(5)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,写出二氧化氮与亚硫酸铵反应的化学方程式( ) 。
37.[Cu(NH3)4]SO4·H2O是一种杀虫剂。
(1)Cu元素基态原子的电子排布式为___ ____。
(2)元素N、O、S的第一电离能由大到小排列的顺序为___ __。
(3)H元素可与O元素形成H2O和H2O2,H2O2易溶于H2O,其主要原因为______。
(4)H元素与N元素可组成化合物N2H4,其中N原子的轨道杂化方式为___ ___。
(5)与SO互为等电子体的一种分子的化学式为___ ___。
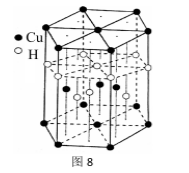
(6)Cu元素与H元素可形成一种红色晶体,其结构如图8,则该化合物的化学式为__ __。
36. 以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:
(1)写出反应Ⅰ的化学方程式 。
(2)生产中,向反应II中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是
。
(3)下列有关说法正确的是 。
a.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
b.反应III中氧化剂与还原剂的物质的量之比为4︰1
c.反应IV需控制在60~
d.反应V中的副产物氯化铵可用作氮肥
(4)反应Ⅴ在25℃、40%乙二醇溶液中进行,不断有硫酸钾晶体从溶液中析出,硫酸钾的产率会超过90%,选用40%乙二醇溶液的原因是 。
(5)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,写出二氧化氮与亚硫酸铵反应的化学方程式 。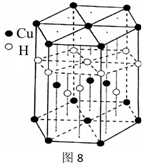
(1)Cu元素基态原子的电子排布式为___ ____。
(2)元素N、O、S的第一电离能由大到小排列的顺序为___ __。
(3)H元素可与O元素形成H2O和H2O2,H2O2易溶于H2O,其主要原因为___ ___。
(4)H元素与N元素可组成化合物N2H4,其中N原子的轨道杂化方式为___ ___。
(5)与SO互为等电子体的一种分子的化学式为 ___ ___。
(6)Cu元素与H元素可形成一种红色晶体,其结构如图8,则该化合物的化学式为__ __。38.菠萝酯是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸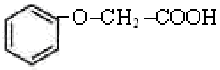
(1)甲一定含有的官能团的名称是 。
(2)5.8g甲完全燃烧可产生0.3mol CO2和0.3 mol H2O,甲蒸气对氢气的相对密度是29,甲分子中不含甲基,且为链状结构,其结构简式是 。
(3)苯氧乙酸有多种酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且有2种一硝基取代物的同分异构体是(写
(4)已知:R-C
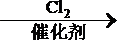
R-ONa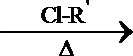
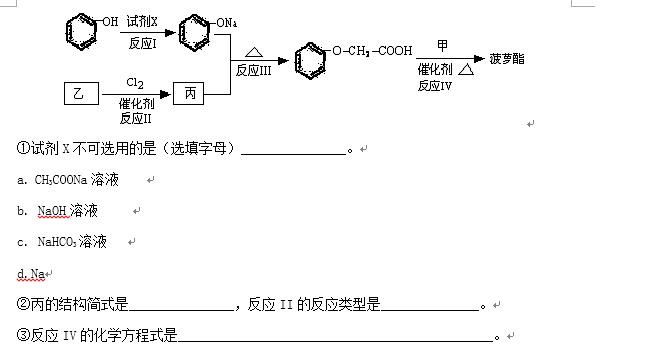
菠萝酯的合成路线如下:
①试剂X不可选用的是(选填字母) 。
a. CH3COONa溶液
b. NaOH溶液
c. NaHCO3溶液
d.Na
②丙的结构简式是 ,反应II的反应类型是 。
③反应IV的化学方程式是 。
正确答案
30.已知:

请回答下列问题:
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
请考生从给出的3道物理题、3道化学题、2道生物题中每科任选一题做答。
36.“C1化学”是指以研究分子中只含一个碳原子的化合物为原料来合成一系列化工原料和燃料的化学。
(1)煤的气化是获得合成气的一种方法,写出煤气化的主要化学反应方程式:( );
(2)天然气的重整的化学反应方程式为( );
(3)最近科学家提出一种“绿色自由’’构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为甲醇。其技术流程如下:
①碳酸钾溶液所起的作用是( ) ;
②写出上述流程中分解池中发生反应的化学方程( );
③写出合成塔中发生的化学反应方程式( );
④“绿色自由”构想技术流程中常包括物质和能量的循环利用,上述流程中能体现循环利用的物质有( )。
37.在电解炼铝过程中加入冰晶石(用“A”代替),起到降低Al2O3的熔点等诸多作用,冰晶石的生产原理如下:
2Al(OH)3+ 12HF+ 3 Na2CO3 = 2A+ 3CO2↑+ 9H2O
根据题意完成下列填空:
(1)冰晶石的化学式为( ),含有离子键、( )等化学键;
(2)生成物中含有10个电子的分子是 (写分子式),该分子的空间构型为 ( ),中心原子的杂化方式为 ( );
(3)反应物中电负性最大的元素为( ),写出其原子最外层的电子排布图:
(4)冰晶石由两种微粒构成,冰晶石晶胞结构如图丁所示,位于大立方体顶点和面心,位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的
体心处▽所代表的微粒是 ( )(填具体的微粒符号)
(5)Al单质的晶体中原子的堆积方式如下图甲所示,其晶胞特征如
下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
若已知Al的原子半径为d,NA代表阿伏加德罗常数,Al的相对原子质量为M,请回答:
一个晶胞中Al原子的数目为( );Al晶体的密度为( ) (用字母表示)
38.酒石酸(tartaric acid),即,2,3-二羟基丁二酸,是一种羧酸﹐存在于多种植物中﹐也是葡萄酒中主要的有机酸之一。作为食品中添加的抗氧化剂﹐可以使食物具有酸味。酒石酸最大的用途是饮料添加剂。也是药物工业原料,以烃A为原料合成酒石酸的流程如下:
(1)A的名称为:( ),分子中最多有( )个原子共面;
(2)B中所含官能团的名称是( ),B存在顺反异构,它的顺式结构为( );
(3)C转化为D的反应类型是 ( ),
F转化为G的化学反应方程式是 ( );
(4)F与乙二醇在一定条件下可以发生缩聚反应,该反应的化学方程式是___________
(5)C的同分异构体有多种,其中含有“—COO—”结构的有 ( )种;
(6)欲得到较纯净的酒石酸,需将G从其溶液中分离提纯,查阅相关资料得知G的溶解度受温度影响较大,则分离提纯G的方法是 ( )。
36.“C1化学”是指以研究分子中只含一个碳原子的化合物为原料来合成一系列化工原料和燃料的化学。
(1)煤的气化是获得合成气的一种方法,写出煤气化的主要化学反应方程式:
;
(2)天然气的重整的化学反应方程式为 ;

①碳酸钾溶液所起的作用是 ;
②写出上述流程中分解池中发生反应的化学方程 ;
③写出合成塔中发生的化学反应方程式 ;
④“绿色自由”构想技术流程中常包括物质和能量的循环利用,上述流程中能体现循环利用的物质有 。37.在电解炼铝过程中加入冰晶石(用“A”代替),起到降低Al2O3的熔点等诸多作用,冰晶石的生产原理如下:
2Al(OH)3+ 12HF+ 3 Na2CO3 = 2A+ 3CO2↑+ 9H2O
根据题意完成下列填空:
(1)冰晶石的化学式为 ,含有离子键、 等化学键;
(2)生成物中含有10个电子的分子是 (写分子式),该分子的空间构型为 ,中心原子的杂化方式为 ;
(3)反应物中电负性最大的元素为 ,写出其原子最外层的电子排布图:



体心处▽所代表的微粒是 (填具体的微粒符号)

下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
若已知Al的原子半径为d,NA代表阿伏加德罗常数,Al的相对原子质量为M,请回答:
一个晶胞中Al原子的数目为 ;Al晶体的密度为 (用字母表示)38.酒石酸(tartaric acid),即,2,3-二羟基丁二酸,是一种羧酸﹐存在于多种植物中﹐也是葡萄酒中主要的有机酸之一。作为食品中添加的抗氧化剂﹐可以使食物具有酸味。酒石酸最大的用途是饮料添加剂。也是药物工业原料,以烃A为原料合成酒石酸的流程如下:
已知:① 烃A中碳氢质量比为8:1
②
③ D的分子组成是C4H8O2Cl2 ,核磁共振氢谱显示其有三个峰。
(1)A的名称为: ,分子中最多有 个原子共面;
(2)B中所含官能团的名称是 ,B存在顺反异构,它的顺式结构为 ;
(3)C转化为D的反应类型是 ,
正确答案
请考生从给出的3道物理题、3道化学题、2道生物题中每科任选一题做答。
36.(1)粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO2-4等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______________(填序号)
(2)工业生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。选择适宜的催化剂,是否可以提高SO2的转化率? (填“是”或“否”),是否可以增大该反应所放出的热量?
(填“是”或“否”);
(3)水是一种重要的自然资源,天然水在净化处理过程中加入的混凝剂可以是 __ (填两种物质名称),其净水作用的原理是
(4)硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO)。若某天然水中
c(Ca2)=1.2×10-3mol/L,c(Mg2+)=6×10-4mol/L,则此水的硬度为_________。
(5)若(4)中的天然水还含有c(HCO3-)=8×10-4mol/L,现要软化10m3这种天然水,则需先加入


请回答下列问题:
(1)请写出A的分子式
(2)1molA在氢氧化钠溶液中加热,充分反应消耗氢氧化钠 mol
(3)有机物C可以由乳酸(
a.消去、加成、水解、酸化
b.氧化、加成、水解、酸化
c.取代、水解、氧化、酸化
d.消去、加成、水解、氧化
(4)写出由E制得F的化学方程式: ,
反应类型是
(5)有机物B与乙酸酐(CH3COOCOCH3)直接反应制得阿司匹林(即乙酰水杨酸,分子式 C9H8O4),满足以下条件的阿司匹林的同分异构体有 种。
①苯环上只含有两个侧链 ②有两个酯基 ③能发生银镜反应
写出其中核磁共振氢谱是3:2:2:1的结构简式: 、
正确答案
正确答案
30.已知A的蒸汽对氢气的相对密度为35,把0.2摩尔A在足量氧气中完全燃烧的产物通过盛足量浓硫酸的洗气瓶,洗气瓶增重10.8克,再通过盛足量碱石灰的干燥管,干燥管增重35.2克,化合物M是一种医用高分子材料,可用于制造隐形眼镜;以下是M、有机玻璃的原料H的合成路线。
已知:

(2)H在一定条件下可氧化为A;

(4)CH2=CH-CH3 + HCHO CH2=CH-CH=CH2 + H2O
请回答下列问题:
(1)A中含有的官能团的名称__________________,G → H的反应条件是______________,
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析