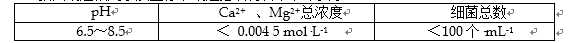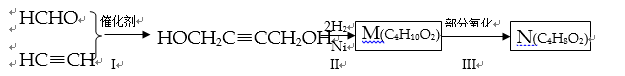- 有机物的推断
- 共316题
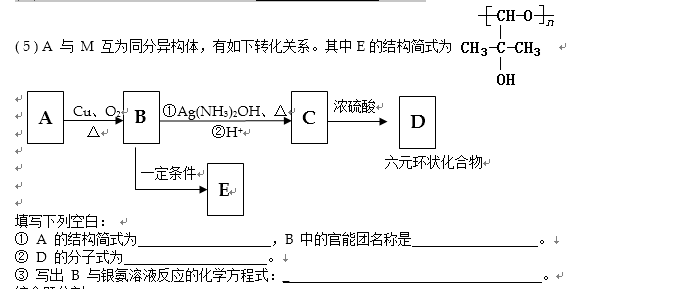
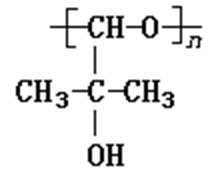
7.分子式为C5H10O2的有机物A有下列变化关系
其中B、C的相对分子质量相等,则B为( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.下表中所列的都是烷烃,它们的一卤取代物均只有一种,分析下表中各项的排布规律,按此规律排布第6项应为( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
请考生从给出的3道物理题、3道化学题、2道生物题中每科任选一题做答。
36.【化学——选修2化学与技术】
(1)下列关于工业生产说法正确的是 ( ) 。(填序号)
A.在侯氏制碱工业中,向饱和氯化钠溶液中先通二氧化碳,后通氨气
B.在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率
C.在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室
D.工业上采用电解熔融氯化铝的方法制取金属铝
E.石油裂化属于化学变化,主要目的是为了获得短链不饱和气态烃
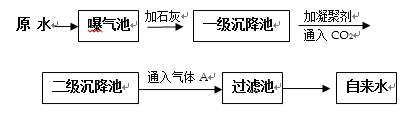
(2)我国规定饮用水质量标准规定必须符合下表中要求:
以下是原水处理成自来水的工艺流程示意图:
①原水中含Ca2+ 、Mg2+ 、HCO3-、Cl-等,加入石灰生成Ca(OH)2,进而发生若干复分解反应,写出其中的离子方程式(只要求写出两个):( ); ( )。
②FeSO4·7H2O是常用的凝聚剂,它在水中最终生成 ( ) 沉淀;通入二氧化碳的目的是 ( ) 和 ( ) 。
③气体A的作用是( ),下列物质中( ) 可以作为气体A的代用品(填编号)。a.ClO2 b.浓氨水 c.K2FeO4 d.SO2 e.漂白粉
37.【化学——选修3物质结构与性质】A、B、C、D、E、F、G是原子序数依次增大的七种元素,其中A、B、C、D、E为短周期元素, F、G为第四周期元素。已知:A是原子半径最小的元素,B、C、D是紧邻的三个族的元素,C的三价阴离子和E的二价阳离子具有相同的电子层结构,F元素的基态原子具有六个成单电子,G是ⅠB族的元素。回答下列问题:(1) 写出E、F、G的元素符号 ( ) ,B、C、D元素的第一电离能由大到小的顺序是 ( ) (用元素符号表示),A元素分别与B、D元素形成的二种微粒都具有NH3相似的结构,属于等电子体,它们的化学式是 ( ) 。(2) F元素的原子基态价层电子排布图是 ( ) 。
⑶向G的硫酸盐溶液中滴加氨水会生成蓝色沉淀,继续滴加氨水至沉淀刚好全部溶解时可得到蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[G(NH3)4]SO4·H2O沉淀。该深蓝色沉淀中的NH3通过________键与中心离子G2+结合;NH3分子中N原子的杂化方式是________;
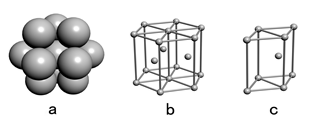
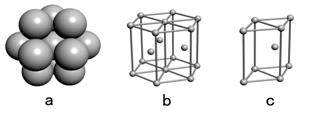
(4)E单质晶体中原子的堆积模型如右图,晶胞是图中的( )
(填a、b或c);配位数是( );若紧邻的四个E原子的中心连线构成的几何体的体积是a cm3,E单质的密度为ρg/ cm3;则E的相对原子质量的计算式是 ( ) 。
38.【化学——选修5有机化学基础】
以 HCHO 和 C2H2为有机原料,经过下列反应可得化合物 N ( C4H8O2)。
( l )反应Ⅰ的反应类型为 ( ) 。 ( 2 ) HOCH2C≡CCH2OH 分子中,在同一个平面的原子最多有 ( ) 个。 ( 3)化合物 M 不可能发生的反应是 ( ) (填序号)。 A.氧化反应 B.取代反应 C.消去反应 D.加成反应 E.还原反应 ( 4 ) N 的同分异构体中,属于酯类的有 ( )种。
36.(15分)【化学——选修2化学与技术】
(1)下列关于工业生产说法正确的是 。(填序号)
37.(15分)【化学——选修3物质结构与性质】
正确答案
正确答案
请考生从给出的3道物理题、3道化学题、2道生物题中每科任选一题做答。
36.(15分)[化学选修一化学与技术]
工业生产Na2S常用方法是:无水芒硝(Na2SO4)一碳还原法,其流程示意图如下:
(1)若煅烧阶段所得气体为等物质的量CO和CO2。写出煅烧时发生的总反应方程式:
;
(2)用碱液浸出产品比用热水更好,理由是: ;
(3)废水中汞常用硫化钠除去,汞的除去率与溶液pH和硫化钠实际用量与理论用量比值X的关系如右图所示。为使除汞达到最佳效果,应控制条件是 。
(4)取Na2S(含少量NaOH),加人到CuSO4溶液中,充分搅拌,若反应后溶液pH=4,此时溶液中c(S 2-)= ;(保留2位有效数字)(已知:CuS Ksp=8.8×10-36;Cu(OH)2 Ksp=2.2×10-20)
(5)纳米Cu2O常用电解法制备,制备过程用铜棒和石墨棒作电极,Cu(NO3)2作电解液。电解生成Cu2O应在 ;该电极pH将 (填“升高”,“不变”或“降低”),用电极方程式解释pH发生变化的原因: 。37.(15分)(化学选修一物质结构与性质]

有机物A、B、C、D、E、F、G有一个相同官能团,它们之间有下图转化关系:
已知:
①A的相对分子质量比B大2;②RCH2OH
根据以上信息回答下列问题:
(1)各物质均含有官能团的名称是 ;化合物G的结构简式为 ;
(2)实现A—E转化的反应类型是 ;实现E→F转化的一定条件是 ;
(3)化合物B在Ni催化条件能与H2发生加成,理论上1mol B最多可能消耗H2的物质的量为 ;
(4)写出B与银氨溶液反应的方程式: ;
(5)写出同时满足下列三个条件的F同分异构体共有 种;写出其中一种的结构简式: 。(不包括立体异构)
a.苯环上只有一个侧链 b.属于酯类化合物 c.含一个碳碳双键
正确答案
正确答案
请考生从给出的3道物理题、3道化学题、2道生物题中每科任选一题做答。
36.由铝土矿(主要成分是Al2O3)炼制铝的工艺流程示意图如下:
(1)电解生成的铝在熔融液的______ (填“上层”或“下层”),电解时不断消耗的电极是______ (填“阴极”或“阳极”)。
(2)写出通入过量二氧化碳酸化时反应的离子方程式______。
(3)电解制备锅时,需加入冰晶石(Na3AlF6),其作用是______,工业上可以用氟化氢气体、氢氧化铝和纯碱在高温条件下发生反应来制取冰晶石,写出 该反应的化学方程式______

(5)对金属制品进行抗腐蚀处理,可延长其使用寿命。
①控制一定条件进行电解(见右图),此时铝表面可形成 耐酸的致密氧化膜,其电极反应式为______;
②钢材镀铝后,能防止钢材腐蚀,其原因是______37. VA族的氮、磷、砷(As)、锑(Sb)等元素在化合物中常表现出多种氧化态,含VA 族元素的化合物在科研和生产中有许多重要用途。请回答下列问题:
(1)N、P、As原子的第一电离能由大到小的顺序为______ (用元素符号表示)。
(2)As原子核外M层电子的排布式为______。

(4)白磷(P4)的结构如右图所示,P原子的轨道杂化方式是______ 。
(5)NO2-可以与许多金属离子形成配合物,例如[Co(NO2)6]3-,它可以用来检验K+, 其反应如下:
①NO2-的立体构型是______;
②在
(6)天然氨基酸的命名常用俗名(根据来源与性质),例如,最初从蚕丝中得到的氨基酸叫 丝氨酸(


①醛(或酮)在NaOH溶液中与HCN反应,可引入腈基(一CN),棱碳链增长。
如:
②腈在酸性条件下水解生成羧酸。
如:
回答下列问题:
(1)C2H4的某种二氯取代物C1CH=CHC1是否存在顺反异构?______(填“是”或“否”)。
(2)反应⑥投料时,通常使B原料过量,其目的是______; B的质谱图中,某碎片离子的质荷比为31,该碎片离子所含碳、氢、氧原子数之比为______。
(3)反应①〜⑥中,属于加成反应的是—(填写反应编号),D的结构简式是______
(4)写出反应⑤的化学方程式__________________
(5)E在催化条件下可聚合成一种易降解的高分子化合物,写出该聚合反应的化学方程 式____________
(6)B与E酯化或丙酮酸乙酯与氢气加成,均可生成有机物G (C5Hi0O3)。G的同分异构体中能发生银镜反应和水解反应,还能与金属钠反应生成氢气的共有______种(不考虑立体异构),其中核磁共振氢谱有四种不同化学环境氢原子的异构体是______ (写出其中一种的结构简式)。
正确答案
扫码查看完整答案与解析