- 氧化还原反应的电子转移数目计算
- 共47题
下列有关氧化还原反应的说法正确的是
正确答案
解析
略
知识点
据报道,科学家发现了如下反应:O2+PtF6=O2(PtF6),已知O2(PtF6)为离子化合物,其中Pt为+5价,对于此反应,下列说法正确的是
正确答案
解析
略
知识点
开发新能源,使用清洁燃料,可以达到提高能效、减少污染的目的。
(1)由C、H、O三种元素中的两种和三种分别组成的燃料物质甲和乙,其分子中均有氧,且1个乙分子中含有18个电子,则甲和乙分别是________。
乙是一种清洁燃料,工业上可用甲和氢气反应制得。
① T1温度时,在体积为2 L的密闭容器中充入2 mol甲和6 mol H2,反应达到平衡后,测得c(甲)=0.2 mol/L,则乙在平衡混合物中的物质的量分数是 。
② 升高温度到T2时,反应的平衡常数为1,下列措施可以提高甲的转化率的是
________(填字母)。
A.加入2 mol甲
B.充入氮气
C.分离出乙
D.升高温度
(2)甲烷也是一种清洁燃料,但不完全燃烧时热效率降低并会产生有毒气体造成污染。
已知:

则甲烷不完全燃烧生成一氧化碳和液态水时的热效率只是完全燃烧时的________倍(计算结果保留1位小数)。
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50 mL 2 mol/L的氯化铜溶液的装置示意图:
请回答:
① 甲烷燃料电池的负极反应式是________。
② 当线路中有0.1 mol电子通过时,________(填“a”或“b”)极增重________g。
正确答案
见解析。
解析
(1)CO(或一氧化碳)和 CH3OH(或甲醇)
① 1/3 (0.33或33.3%)
② C
(2) 0.7
(3)① CH4 -8e- + 2H2O = CO2 + 8H+
② b 3.2
知识点
下图是一些重要工业生产的转化关系(反应条件略去):
请完成下列问题:
(1)若D是单质,且与A属于同一主族,反应在高温下进行,则:
①此反应的化学方程式是 。
②D单质的一种重要用途是 。
(2)若B为黄色固体,D为固体化合物,则该反应为4FeS2+11O2 
①当有1molC生成时,该反应转移电子的总数是 。
②将C通入足量的酸性KMnO4 溶液中,发生反应的离子方程式为 。
(3)若B是一种碱性气体,D为化合物,则:
①该反应的化学方程式是 。
②B在加热条件下与CuO反应有Cu生成,该反应的化学方程式为 ;有人提出产物Cu中可能还含有Cu2O。已知Cu+在酸性溶液中不能稳定存在,为验证Cu2O是否存在,可取少量反应产物,滴加足量稀硫酸,若溶液由无色变为蓝色,则证明含有Cu2O。请写出发生反应的化学方程式:_________。
正确答案
(1)①2C+SiO2 
(2)①3.31×1024
②2MnO4-+5SO2+ 2H2O ===2Mn2++5SO42- +4H+
(3)①4NH3+5O2 
②2NH3+3CuO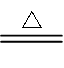
解析
略
知识点
H2O2是一种强氧化剂,被广泛应用于水处理及卫生消毒等方面。
(1)H2O2不稳定,当其中含Fe2+时,会发生反应:
(2)下表是在常压、60℃和不同pH条件下,6mL30%在60minH2O2内释放出氧气的体积。则下列说法正确的是__________。
a. pH越大,H2O2的分解速率越大
b. pH在9左右,H2O2的分解速率最大
c. 6mL30%分解最多释放出的氧气的体积为639mL
d. pH=5.50时,0~60min内,v=1.5mL
(3)溶液中H2O2的残留量可用一定浓度的酸性KMnO4溶液来测定,反应中MnO4-被还原为Mn2+,该反应的离子方程式为__________。
(4)科学工作者以Ir-Ru/Ti为阳极、ACFC为阴极,在酸性环境、不断通入空气的条件下直接电解水来制备H2O2。电解过程中,阳极区溶液的pH_(填“增大”“不变”或“减小”),阴极产生H2O2的电极反应式为__________。若不通空气,则阴极得到的产物是__________。
(5)己知断裂1mol化学键所需的能量

正确答案
(1)催化作用(或催化剂); 0.03
(2)bd
(3)5H2O2+2MnO4-+6H+=2Mn2++5O2↑+8H2O
(4)减小;O2+2H++2e-=H2O2;H2
(5)-135
解析
略。
知识点
扫码查看完整答案与解析



