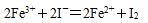- 氧化还原反应的电子转移数目计算
- 共47题
下列叙述中正确的是
正确答案
解析
略
知识点
利用天然气可制得以H2、CO等为主要组成的工业原料合成气,反应为:CH4(g)+H2O(g)=CO(g)+3H2(g)。
(1)甲烷与水蒸气反应,被氧化的元素是________,当生成标准状况下35.84L合成气时转移电子的物质的量是________。
(2)将2 mol CH4和5 mol H2O(g)通入容积为100L的反应室,CH4的平衡转化率与温度、压强的关系如图。
①达到A点所需的时间为5min,则v(H2)=________,100℃时平衡常数K=________。
②图中的P1________P2(填“<”、“>”或“=”),A、B、C三点的平衡常数KA、KB、KC的大小关系是________。
(3)合成气用于合成氨气时需除去CO,发生反应CO(g)+H2O(g)=CO2(g)+H2(g) 

A.降低温度
B.恒温恒容下充入He(g)
C.将H2从体系中分离
D.再通入一定量的水蒸气
可用碳酸钾溶液吸收生成的CO2,常温下pH=10的碳酸钾溶液中水电离的OH-的物质的量浓度为________,常温下,0.1 mol·L-1KHCO3溶液pH>8,则溶液中c(H2CO3)________c(CO32-)(填“>”、“=”或“<”)。
正确答案
(1)C(碳);2.4mol
(2)①0.006mol·L-1·min-1;75×10-4 mol2·L-2;② < ;KC >KB> KA
(3)AC;1×10-4 mol·L-1;>
解析
略。
知识点
植物在白天和晚上分别进行不同的生长,其反应原理如下:
6CO2(g)+6H2O(g) 
正确答案
解析
略
知识点
XeO3是一种不稳定的物质,具有强氧化性。
(1)配平反应的离子方程式:____XeO3



(2)反应现象为:①有气泡产生,② 。
(3)发生氧化反应的物质是 。
(4)将适量的XeO3投入



正确答案
(1) 5,6,9,6,5,18
(2)溶液显紫红色
(3)Mn2+
(4)0.015 pH = 1
解析
略
知识点
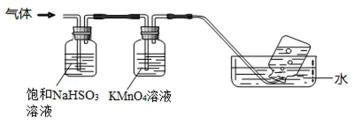
以冶铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
(1)Fe3[Fe(CN)6]2沉淀的颜色 。
(2)图中“滤渣”主要成分在高温条件下与碳单质的反应方程式为 。
(3)加2mol/LHI溶液发生的离子反应方程式为 。
(4)煅烧硫酸铝铵晶体,发生的主要反应为:
4[NH4Al(SO4)2·12H2O] 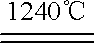
①根据上述方程式,每产生1molAl2O3转移的电子数为 。
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有 (填化学式)。
③KMnO4溶液颜色变浅,发生的离子反应方程式为 。
正确答案
(1)特征蓝色或蓝色
(2)
(3)
(4)①3NA
②NH3和SO3
③5SO2+2H2O+2 MnO 4-= 2 Mn2++5 SO2-+4H+
解析
略
知识点
扫码查看完整答案与解析