- 氧化还原反应方程式的配平
- 共44题
下表中评价合理的是
正确答案
解析
A项注意的是HNO3把+2价的铁也氧化为+3价了,但HNO3应还原为NO气体,故A项评价错误;B项的碳酸镁为微溶物,写离子方程式时应保持化学式;B项评价正确;C项的离子方程式错误,正确为2NH4+ +SO42-+Ba2++2OH-=BaSO4↓+2NH3·H2O;D项的反应是正确的,故D项评价错误。
知识点
向盛KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。
完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):
(2)整个过程中的还原剂是______________________________________。
(3)KI换成KBr,则CCl4层变为____________色;继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是____________________________________。
(4)加碘盐中含碘量为20mg~50mg/kg。制取加碘盐(含KIO3的食盐)1000k9,若用KI与 Cl2反应制KIO3,至少需要消耗Cl2___________________L(标准状况,保留2位小数)。
正确答案
(1)I2 + 5Cl2 + 6H2O→2HIO3 + 10HCl
(2) KI、I2
(3)红棕 HBrO3>Cl2>HIO3
(4) 10.58
解析
略
知识点
若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之比为
正确答案
解析
略
知识点
(1)磷、硫元素的单质和化合物应用广泛。
1)磷元素的原子结构示意图是____________。
2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2=6CaSiO3+P4O10 10C+P4O10=P4+10CO
每生成1 mol P4时,就有________mol电子发生转移。
3)硫代硫酸钠(Na2S2O3)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量。发生的反应为:
C6H8O6+I2=C6H6O6+2H++2I- 2S2O32-+I2=S4O62-+2I-
在一定体积的某维生素C溶液中加入a mol·L-1 I2溶液V1 mL,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b mol·L-1 Na2S2O3溶液V2 mL。该溶液中维生素C的物质的量是__________mol。
4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2IO3-+5SO32-+2H+=I2+5SO42-+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
该实验的目的是_____________;表中V2=___________mL。
(2)、稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。
5)铈(Ce)是地壳中含量最高的稀土元素。在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备。其中NH4Cl的作用是______________。
6)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:
____Ce3++____H2O2+____H2O =____Ce(OH)4↓+____ _______
正确答案
见解析。
解析
1)写出P原子的结构示意图: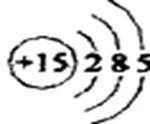
2)每生成1 mol P4时,P由+5价变成0价,电子转移为5×4=20或C化合价由0价变成为+2价,电子转移为2×10=20;
3)n(Na2S2O3)=bV1/1000 mol;与其反应的I2为bV1/2000 mol,与维生素C反应的I2为 
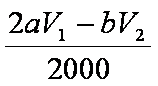
4)由实验2可以看出混合液的总体积为50mL,V1为10mL,V2为40mL,实验1和实验2可知实验目的是探究该反应速率与亚硫酸钠溶液浓度的关系;实验2和实验3可知实验目的是探究该反应速率与温度的关系。
5)题目中给出:“加热条件下CeCl3易发生水解”,可知NH4Cl的作用是肯定是抑制水解的,CeCl3水解会生成HCl,可以完整答出:NH4Cl的作用是分解出HCl气体,抑制CeCl3水解。
6)根据题意:“强酸性”或观察方程式可知缺项是H+,利用电子得失守恒或观察法就可以配平方程式。2Ce3++H2O2+6H2O= 2Ce(OH)4↓+6H+
知识点
已知氧化性Br2>Fe3+。FeBr2溶液中通入一定量的Cl2,发生反应的离子方程式为:
a Fe2++b Br-+c Cl2→d Fe3++ e Br2+ f Cl-
下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是
正确答案
解析
略
知识点
扫码查看完整答案与解析