- 化学研究方法与工业化学
- 共64题
1.物质的性质决定其用途,下列应用中利用了物质氧化性的是
正确答案
解析
A.氧化铝用于耐火材料是利用了氧化铝熔沸点较高的特点。
B.碳酸钠溶液呈碱性,对酯类物质的水解起促进作用。
C.食醋成分是醋酸,有机酸具有酸的基本通性,能与碳酸钙、氢氧化镁反应,将水垢溶解,从而达到除去的目的。
D.次氯酸以及次氯酸盐具有强氧化性,能用于漂白杀菌、消毒,故正确。
考查方向
解题思路
常见化学物质的组成、结构、性质、应用、制备
易错点
常见物质的氧化性、还原性判断,常见物质的应用
知识点
20.将磷肥生产中形成的副产物石膏(CaSO4•2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义.以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图.
(1)本工艺中所用的原料除CaSO4•2H2O、KCl外,还需要___________等原料
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式:
___________
(3)过滤Ⅰ操作所得固体中,除CaCO3外还含有___________(填化学式)等物质,该固体可用作生产水泥的原料.
(4)过滤Ⅰ操作所得滤液是(NH4)2SO4溶液.检验滤液中含有CO32﹣的方法是:___________
(5)已知不同温度下K2SO4在100g水中达到饱和时溶解的量如下表:
60℃时K2SO4的饱和溶液591g冷却到0℃,可析出K2SO4晶体__________g
(6)氯化钙结晶水合物(CaCl2•6H2O)是目前常用的无机储热材料,选择的依据是_______
(7)上述工艺流程中体现绿色化学理念的是:___________
正确答案
(1)CaCO3(或CaO)、NH3、H2O.
(2)CaSO4+CO32﹣=CaCO3+SO42﹣
(3)CaSO4;
(4)取少量溶液,滴加稀盐酸,若有气泡产生则还含有CO32﹣,反之则不含有CO32﹣;
(5)54;
(6)ad;
(7)碳酸钙用于制水泥原料、硫酸钙和氯化钾转化为硫酸钾和氯化钙、氨在工艺中循环使用等(原子利用率高,没有有害物质排放到环境中).
解析
解析已在路上飞奔,马上就到!
知识点
7.2015年8月12日,天津滨海新区某公司的仓库发生爆炸,事发仓库里存放了大量的硝酸铵、氰化钠、电石和金属钠等危险化学品。下列有关叙述正确的是( )
正确答案
解析
】A.危险化学品虽然危害人类健康,但是作为化工原料不应禁止生产,所以A错误;
B.金属钠是固体,容易燃烧,所以B正确;
C.固体可燃物如金属钠燃烧不能用水扑灭,所以C错误;
D.金属钠是单质,不属于电解质,所以D错误
考查方向
解题思路
A.危险化学品虽然危害人类健康,但是重要的化工原料;
B.金属钠是固体,容易燃烧;
C.固体可燃物如金属钠燃烧不能用水扑灭;
D.金属钠是单质,不属于电解质
易错点
A.不清楚危险化学品虽然危害人类健康,但是作为化工原料不应禁止生产;B.不清楚金属钠是固体可燃物;C.不清楚固体可燃物燃烧不能用水扑灭;D.不清楚金属钠不属于电解质
知识点
下列关于硫酸工业生产过程的叙述错误的是
正确答案
解析
本题通过硫酸工业生产考查考生化学与技术,意在考查考生对硫酸工业的理解。硫酸工业生产中,在接触室中用铁触媒作催化剂,使SO2氧化为SO3,A项错误;使用热交换装置可节约能源,B项正确;把硫铁矿磨碎可增大其与氧气的接触面,使反应更充分,速率更快,可提高原料的利用率,C项正确;反应温度采用450~500℃是因为该温度下催化剂活性最高,D项正确。
知识点
亚硫酸盐是一种常见食品添加剂。为检验某食品中亚硫酸盐含量(通常以1 kg样品中含SO2的质量计),某研究小组设计了如下两种实验流程:
(1)气体A的主要成分是________。为防止煮沸时发生暴沸,必须先向烧瓶中加入______;通入N2的目的是____________。
(2)写出甲方案第①步反应的离子方程式:__________。
(3)甲方案第②步滴定前,滴定管需用NaOH标准溶液润洗,其操作方法是_________。
(4)若用盐酸代替稀硫酸处理样品,则按乙方案实验测定的结果_______(填“偏高”、“偏低”或“无影响”)。
(5)若取样品w g,按乙方案测得消耗0.01000 mol•L-1 I2溶液V mL,则1 kg样品中含SO2的质量是______g(用含w、V的代数式表示)。
正确答案
(1)SO2 和N2 碎瓷片(或沸石) 将生成的SO2全部赶出
(2)SO2+H2O2==2H++SO42-
(3)向碱式滴定管中注入少量NaOH标准溶液,倾斜转动滴定管润洗全部内壁后从尖嘴放出液体,重复操作2~3次
(4)无影响
(5)
解析
略
知识点
(一)固硫剂是把煤燃烧时生成的二氧化硫以盐的形式固定在炉渣中的物质,可减少二氧化硫对大气的污染。下列物质中可用做固硫剂的有
A.CaO
B.Na2C03
C.NH4N03
D.P205
(二)以黄铁矿为原料,采用接触法生产硫酸的流程可简示如下:
请回答下列问题:
(1)在炉气制造中,生成S02的化学方程式为______________________________;
(2)炉气精制的作用是将含S02的炉气_______________、_______________及干燥,如果炉气不经过精制,对S02催化氧化的影响是__________________________________。
(3)精制炉气(含SO2体积分数为7%、O2为ll%、N2为82%)中S02平衡转化率与温度及压强关系如下图所示。在实际生产中,S02催化氧化反应的条件选择常压、450℃;左右(对应图中A点),而没有选择S02转化率更高的B或C点对应的反应条件,其原因分别是______________________________、______________________________;
(4)在S02催化氧化设备中设置热交换器的目的是_______________、_______________,从而充分利用能源。
正确答案
见解析。
解析
(一)二氧化硫是一种酸性氧化物,在所给的物质中能与二氧化硫反应的只有选项A、B。因此选项A、B正确。
(二)(1)4FeS2+11O2
(2)除尘、水洗;砷、硒等化合物会使催化剂中毒,水蒸气对设备和生产有不良影响
(3)不选B点,因为压强越大对设备的投资越大,消耗的动能越大。SO2的转化率在1个大气压下的转化率已达到97%左右,在提高压强,SO2的转化率提高的余地很小,所以采用1个大气压;不选C点,因为温度越低,SO2的转化率虽然更高,但催化剂的催化作用会受影响,450℃时,催化剂的催化效率最高,故选择A点,而不选择C点。
(4)利用反应放出的热量预热原料气体;上层反应气经热交换器温度降到400~500℃进入下层使反应更加完全。
知识点
硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸。
(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为:_________,该反应在_________中进行(填设备名称)。
(2)为了有利于SO2转化为SO3,且能充分利用热能,采用了多层催化剂且有热交换器的_________(填设备名称)中进行反应。在如图所示的装置中,C处流出的气体有_________;SO3进入_________(填设备名称)用_________吸收,得到浓硫酸或发烟硫酸。
(3)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是_________。
(4)吸收塔排出的尾气中SO2的含量如果超过500
正确答案
(1)4FeS2 +11 O2高温2Fe2O3+ 8SO2;沸腾炉
(2)接触室;SO3、SO2、O2;吸收塔;98.3%的H2SO4
(3)400℃,1个标准大气压
(4)2NH3·H2O + SO2 =(NH4)2SO3+ H2O
解析
略。
知识点
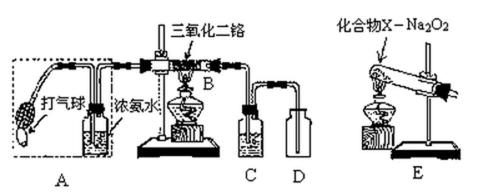
某兴趣小组用题27图装置探究氨的催化氧化。
(1)氨催化氧化的化学方程式为___________________。
(2)加热玻璃管2一段时间后,挤压1中打气球鼓入空气,观察到2中物质呈红热状态;停止加热后仍能保持红热,该反应是_________反应(填“吸热”或“放热”)。
(3)为保证在装置4中观察到红棕色气体,装置3应装入_________;若取消3,在4中仅观察到大量白烟,原因是___________________。
(4)为实现氨催化氧化,也可用装置5替换装置_________(填装置代号);化合物X为_________(只写一种),Na2O2的作用是___________________。
正确答案
(1)4NH3+5O2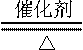
(2)放热
(3)浓H2SO4;生成的NO与O2反应生成NO2,NO2与水反应生成HNO3,NH3与HNO3反应生成了
(4)I; 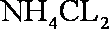
解析
本题考查氨的催化氧化。(1)

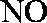
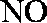
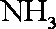



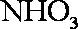
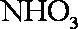

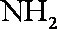

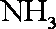
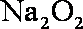

知识点
下列有关说法不正确的是
正确答案
解析
略
知识点
硫酸工业在国民经济中占有极其重要的地位。我国采用“接触法’’制硫酸,设备如图所示:
(1)用黄铁矿为原料生产SO2,反应的化学方程式为________,该反应在________进行(填设备名称)。
(2)为提高SO3吸收率,实际生产中用 吸收SO3;这样做的优点是________。
(3)由A排出的炉渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3化合而成),其中硫酸铜的质量分数随温度不同而变化(见下表):
已知CuSO4在低于660℃时不会分解,请简要分析上表中CuSO4的质量分数随温度升高而降低的原因________。
(4)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法的流程如下:
试写出②、④的化学反应方程式________。
正确答案
(1)4FeS2 +11O2 
(2)98.3%浓硫酸;防止吸收过程中产生酸雾,提高SO3吸收率和硫酸的产率
(3)SO2转化为SO3是正反应放热的可逆反应,随温度升高,平衡逆移,SO3物质的量减少,故CuSO4的量减少(或温度升高,SO3物质的量减少,故CuSO4的量减少)
(4)NaOH+SO2=NaHSO3;NaHSO3+HCl=NaCl+H2O+SO2↑
解析
略。
知识点
扫码查看完整答案与解析