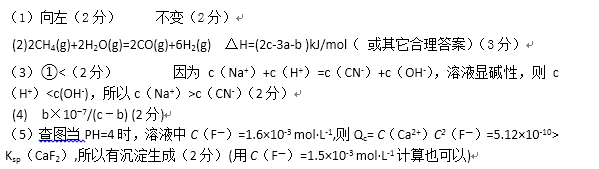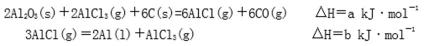- 盖斯定律的计算
- 共35题
13. 取少量0.1mol/
kJ·mol-1, 则Na2SO4(aq)+Ba(NO3)2(aq)=BaSO4(s)+2NaNO3(aq)∆H=( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
23. 请按要求完成下列各小题:
(1)合成氨反应N2 (g)+3H2(g)
气,则平衡( )(填“向左”“向右”或“不”) 移动;使用催化剂,上述反应的△H_______(填“增大” “减小” 或“不变”)。
(2)已知甲烷在高温下与水蒸气反应生成CO和H2。现有部分物质燃烧的热化学方程式如下: 2H2(g)+ O2(g)= 2H2O(g) △H=a kJ/mol
2CO(g)+ O2(g)= 2CO2(g) △H=b kJ/mol
CH4(g)+ 2O2(g)=CO2(g) + 2H2O(g) △H=ckJ/mol
请写出甲烷和水蒸气在高温下反应的热化学方程式( )。
(3)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液。向其中加入少量酸或碱时,溶液的酸碱性变化不大。现将0.04mol·L-1HA溶液和0.02mol·L-1NaOH溶液等体积混合,得到缓冲溶液。
若HA为HCN,该溶液显碱性,则溶液中
(4)在25℃时,将c mol · L-1的醋酸溶液与b mol · L-1NaOH溶液等体积混合后溶液刚好呈中性,用含b、c的代数式表示CH3COOH的电离常数Ka =____________________。
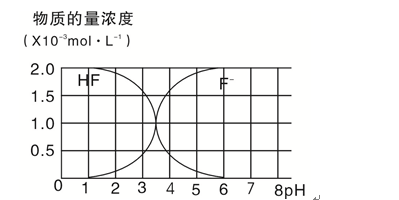
(5)25℃时,2.0×10-3 mol·L-1HF溶液中,调节溶液pH(忽略溶液体积变化)得到的(HF)、c(F—)与溶液pH的变化关系如图。若将4.0×10-4 mol·L-1CaCl2溶液与4.0×10-3 mol·L-1HF溶液等体积混合,调节混合液pH=4(忽略调节时混合液体积的变化),通过列式计算说明是否有CaF2沉淀析出。[已知Ksp(CaF2):1.5×10-10]( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.二氧化硫和氮氧化物(NOx)对大气污染日趋严重,研究消除大气污染的方法是化学工作者的重要课题,目前有很多种方法消除大气污染。
(1)可利用甲烷催化还原NOx的方法处理NOx ,反应如下:
(3)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42- 而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为( );
(4)肼(N2H4)用亚硝酸氧化可生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977。写出肼与亚硝酸反应的化学方程式( );
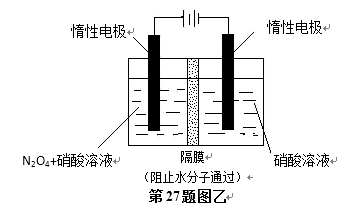
(5)N2O5是重要的硝化剂和氧化剂,可用电解法制备N2O5,如图乙所示,N2O5在电解池的 ( )(填“阳极”或“阴极”)区生成,其电极反应式为( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,研究碳及其化合物的综合利用对促进低碳社会的构建具有重要的意义。请运用相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26.一氧化碳是一种用途相当广泛的化工基础原料。
(1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。
Ni(s)+4CO(g)
(2)在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
(3)工业上一般采用CO与H2反应合成可再生能源甲醇,反应如下:
①某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应达到平衡后,测
得c(CO)=0.2mol·L-1,则CO的转化率为( )。
②合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,通过反应进行甲醇合成,T1℃下此反应的平衡常数为160。此温度下,在密闭容器中加入一定量CO和H2,反应到某时刻测得各组分的浓度如下:
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.已知:
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.已知下列热化学方程式:
Zn(s)+
Hg(1)+
Zn(s)+HgO(s)==ZnO(s)+Hg(1)的焓变△H为( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.新的《环境空气质量标准》(GB3095-2012)将于2016年1月1日在我国全面实施。据此,环境空气质量指数(AQI)日报和实时报告包括了 S02、NO2, CO、O3,PM10、PM2.5等指标,为公众提供健康指引,引导当地居民合理安排出行和生活。
(1) 汽车排出的尾气中含有CO和NO等气体,用化学方程式解释产生NO的原因______。

已知:
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用。
(1)真空碳热还原—氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H= kJ·mol-1(用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g) 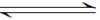
①0~10min内,NO的平均反应速率v(NO)=( ),T1℃时,该反应的平衡常数K=( );
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是( )(填字母编号)。
a.通入一定量的NO b.加入一定量的活性炭
c.加入合适的催化剂 d.适当缩小容器的体积
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,则Q( )0(填“>”或“<”)。
④在恒容条件下,能判断该反应一定达到化学平衡状态的依据是( )(填选项编号)。
a.单位时间内生成2n mol NO(g)的同时消耗n mol CO2(g)
b.反应体系的温度不再发生改变
c.混合气体的密度不再发生改变
d.反应体系的压强不再发生改变
(3)铝电池性能优越,Al—Ag2O电池可用作水下动力电源,其原理如下图所示:
请写出该电池正极反应式 ( );常温下,用该化学电源和惰性电极电解300ml硫酸铜溶液(过量),消耗27mg Al,则电解后溶液的pH=( )(不考虑溶液体积的变化)。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.现在科学家正在寻求将太阳能转化成化学能,其中办法之一就是利用太阳能将H2O分解成H2,再将化学能转化为其它能源。下面是有关的能量循环示意图,下列有关说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析