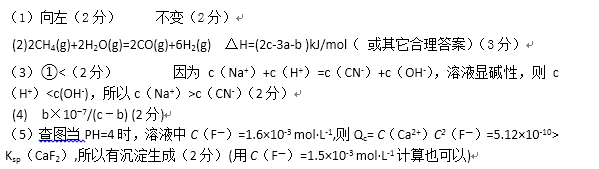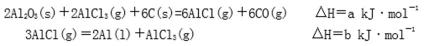- 盖斯定律的计算
- 共35题
23. 请按要求完成下列各小题:
(1)合成氨反应N2 (g)+3H2(g)
气,则平衡( )(填“向左”“向右”或“不”) 移动;使用催化剂,上述反应的△H_______(填“增大” “减小” 或“不变”)。
(2)已知甲烷在高温下与水蒸气反应生成CO和H2。现有部分物质燃烧的热化学方程式如下: 2H2(g)+ O2(g)= 2H2O(g) △H=a kJ/mol
2CO(g)+ O2(g)= 2CO2(g) △H=b kJ/mol
CH4(g)+ 2O2(g)=CO2(g) + 2H2O(g) △H=ckJ/mol
请写出甲烷和水蒸气在高温下反应的热化学方程式( )。
(3)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液。向其中加入少量酸或碱时,溶液的酸碱性变化不大。现将0.04mol·L-1HA溶液和0.02mol·L-1NaOH溶液等体积混合,得到缓冲溶液。
若HA为HCN,该溶液显碱性,则溶液中
(4)在25℃时,将c mol · L-1的醋酸溶液与b mol · L-1NaOH溶液等体积混合后溶液刚好呈中性,用含b、c的代数式表示CH3COOH的电离常数Ka =____________________。
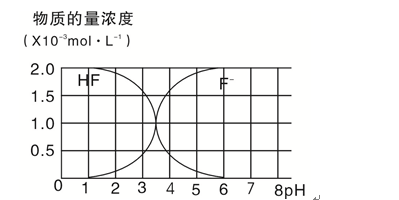
(5)25℃时,2.0×10-3 mol·L-1HF溶液中,调节溶液pH(忽略溶液体积变化)得到的(HF)、c(F—)与溶液pH的变化关系如图。若将4.0×10-4 mol·L-1CaCl2溶液与4.0×10-3 mol·L-1HF溶液等体积混合,调节混合液pH=4(忽略调节时混合液体积的变化),通过列式计算说明是否有CaF2沉淀析出。[已知Ksp(CaF2):1.5×10-10]( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26.一氧化碳是一种用途相当广泛的化工基础原料。
(1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。
Ni(s)+4CO(g)
(2)在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
(3)工业上一般采用CO与H2反应合成可再生能源甲醇,反应如下:
①某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应达到平衡后,测
得c(CO)=0.2mol·L-1,则CO的转化率为( )。
②合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,通过反应进行甲醇合成,T1℃下此反应的平衡常数为160。此温度下,在密闭容器中加入一定量CO和H2,反应到某时刻测得各组分的浓度如下:
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.已知:
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.已知下列热化学方程式:
Zn(s)+
Hg(1)+
Zn(s)+HgO(s)==ZnO(s)+Hg(1)的焓变△H为( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用。
(1)真空碳热还原—氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H= kJ·mol-1(用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g) 
①0~10min内,NO的平均反应速率v(NO)=( ),T1℃时,该反应的平衡常数K=( );
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是( )(填字母编号)。
a.通入一定量的NO b.加入一定量的活性炭
c.加入合适的催化剂 d.适当缩小容器的体积
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,则Q( )0(填“>”或“<”)。
④在恒容条件下,能判断该反应一定达到化学平衡状态的依据是( )(填选项编号)。
a.单位时间内生成2n mol NO(g)的同时消耗n mol CO2(g)
b.反应体系的温度不再发生改变
c.混合气体的密度不再发生改变
d.反应体系的压强不再发生改变
(3)铝电池性能优越,Al—Ag2O电池可用作水下动力电源,其原理如下图所示:
请写出该电池正极反应式 ( );常温下,用该化学电源和惰性电极电解300ml硫酸铜溶液(过量),消耗27mg Al,则电解后溶液的pH=( )(不考虑溶液体积的变化)。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析