- 化学实验
- 共767题
graduation
正确答案
grandchild
正确答案
graduate
正确答案
14.某矿抽出的废液中含有大量的K+、Cl-、Br-,还有少量的Ca2+、Mg2+、
可供试剂a、b的选择试剂:饱和Na2CO3溶液、饱和K2CO3溶液、KOH溶液、BaCl2溶液、Ba(NO3)2溶液、H2O2溶液、KMnO4(H+)溶液、稀盐酸。
请根据以上流程,回答相关问题:
(1)试剂a应该选用________。
(2)操作①、②、③、④、⑤的名称是____________________(填字母)。
A.萃取、过滤、分液、过滤、蒸发结晶
B.萃取、分液、蒸馏、过滤、蒸发结晶
C.分液、萃取、过滤、过滤、蒸发结晶
D.萃取、分液、分液、过滤、蒸发结晶
(3)除去无色液体Ⅰ中的


(4)调节pH的作用是___________________________________,
操作方法是______________________________________________。
(5)操作⑤中用到的瓷质仪器的名称是________。
正确答案
(1)H2O2溶液
(2)B
(3)BaCl2溶液、饱和K2CO3溶液、KOH溶液(KOH溶液、BaCl2溶液、饱和K2CO3溶液或BaCl2溶液、KOH溶液、饱和K2CO3溶液)
(4)中和过剩的KOH及K2CO3 滴加稀盐酸,无气体产生时,用PH试纸测定至PH=7
(5)蒸发皿
解析
解析已在路上飞奔,马上就到!
知识点
11.可用于分离或提纯物质的方法有:
A.分馏 B.盐析 C.过滤
D.重结晶 E.升华 F.渗析
G.电解 H.加热分解
I.蒸馏 J.灼热氧化
如欲分离或提纯下列各组混合物,请选择上述方法中最合适者,并将相应字母填入题后空格内:
(1)从石油中分离出汽油和煤油等成分________;
(2)除去淀粉溶液中的少量碘化钠________;
(3)从油脂皂化反应后的混合液中分离出高级脂肪酸钠________;
(4)除去粗铜中锌、银等金属________;
(5)除去水中的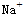
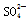
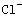
(6)除去KNO3晶体中混有的少量NaCl________。
正确答案
(1)A
(2)F
(3)B
(4)G
(5)I
(6)D
解析
解析已在路上飞奔,马上就到!
知识点
强电解质甲、乙、丙、丁分别溶于水,电离出NH4+、Ba2+、Mg2+、H+、OH-、Cl-、HCO3-、SO42-(每种溶液中溶质电离出的离子各不相同)。已知:① 甲溶液分别与其它三种溶液混合,均产生白色沉淀;② 0.1 mol·L-1乙溶液中c(H+)>0.1 mol·L-1;③ 向丙溶液中滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀。下列结论不正确的是
正确答案
解析
略
知识点
3.下列实验操作能达到目的的是( )
正确答案
解析
A.工业上用Na2CO3溶液浸泡锅炉水垢使其中CaSO4能转化为CaCO3,碳酸钙不溶于水,故A错误;
B.淀粉在稀硫酸作用下水解生成葡萄糖,加NaOH溶液中和稀硫酸,使混合液呈碱性,然后加入银氨溶液,有单质银生成可检验产物葡萄糖,证明淀粉已水解,反之,淀粉未水解;由于淀粉遇碘单质变蓝,所以向水解后的溶液加碘水如果变蓝,则说明淀粉水解不完全,反之,淀粉已完全水解,故B正确;
C.检验溴离子应在酸性溶液中,则水解后、冷却加酸至酸性,再滴加硝酸银溶液来检验卤素的种类,故C错误;
D.水的体积不等于溶液的体积,应加水至溶液的体积等于100mL,故D错误.
考查方向
本题考查化学实验方案的评价,涉及除杂、物质的检验以及溶液配制等知识点
解题思路
A.工业上用Na2CO3溶液浸泡锅炉水垢使其中CaSO4能转化为CaCO3;
B.淀粉遇碘单质变蓝来验证淀粉的存在;
C.检验溴离子应在酸性溶液中;
D.水的体积不等于溶液的体积
易错点
C项中卤代烃中卤族元素原子的检验,注意水解反应或消去反应后要将溶液调节到酸性,再滴入硝酸银进行检验
教师点评
本题考查化学实验方案的评价,涉及除杂、物质的检验以及溶液配制等知识点,在近几年的各省高考题中出现的频率非常高,常与化学实验基本操作、仪器的使用、沉淀的生成与转化、酸性比较、非金属性比较、氧化还原反应等知识点交汇命题
知识点
某无色溶液可能含有①Na+ ②Ba2 + ③Cl一 ④Br一 ⑤SO32一 ⑥SO42一中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
下列结论正确的是
正确答案
解析
略
知识点
某未知溶液可能含Cl-、CO32-、Na+、SO42-、Al3+。将溶液滴在蓝色石蕊试纸上,试纸变红。取少量试液,滴加硝酸酸化的氯化钡溶液,有白色沉淀生成;在上层清液中滴加硝酸银溶液,产生白色沉淀。下列判断合理的是
正确答案
解析
略
知识点
有一固体混合物,可能含有FeCl2、NaNO2、Ba(OH)2、A1C13、Na2SO3中的若干种。取适量该混合物加适量水充分搅拌,得到白色沉淀A与无色溶液B。
①取少量A加入稀硝酸至过量,白色沉淀部分溶解
②取少量B逐滴加入稀硫酸至过量,不断生成白色沉淀后沉淀部分溶解
③取少量B滴加少量酸性高锰酸钾,振荡,最终得无色溶液
根据上述实验现象,以下推测正确的是 ( )
正确答案
解析
略
知识点
甲、乙、丙、丁四种易溶于水的物质,分别由NH4+、Ba2+、Mg2+、H+、OH-、Cl-、HCO3-、SO42-中的不同阳离子和阴离子各一种组成。已知:①将甲溶液分别与其它三种物质的溶液混合,均有白色沉淀生成;②0.1mol/L乙溶液中c(H+)>0.1mol/L;③向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。下列结论不正确的是( )
正确答案
解析
略
知识点
25℃时,某溶液中含有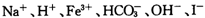
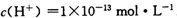
正确答案
解析
略
知识点
某溶液中可能含有Na+、NH4+、Ba2+、SO42-、I-、S2-。分别取样:①用pH计测试,
溶液显弱酸性;②加氯水和淀粉无明显现象。为确定该溶液的组成,还需检验的离子是
正确答案
解析
略
知识点
某工业废水仅含下表中的某些离子,且各种离子的物质的量浓度相等,均为0.1mol/L(此数值忽略水的电离及离子的水解)。
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ、取该无色溶液5 mL,滴加一滴氨水有沉淀生成,且离子种类增加。
Ⅱ、用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰。
Ⅲ、另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅳ、向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由I、Ⅱ判断,溶液中一定不含有的阳离子是 。
(2)Ⅲ中加入盐酸生成无色气体的离子方程式是 。
(3)甲同学最终确定原溶液中所含阳离子有 ,阴离子有 ;并据此推测原溶液应该呈 性,原因是 (请用离子方程式说明)。
(4)另取100 mL原溶液,加入足量的NaOH溶液,此过程中涉及的离子方程式为
。充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体质量为 g。
正确答案
(1)
(2)
(3)Mg2+、Al3+;
(4)
解析
略
知识点
某溶液可能含有Na+ 、Ag+、Al3+、S2-、CO32-、SO32-、NO3-等离子中的数种。向此溶液中加入稀盐酸,有浅黄色沉淀和气体出现,此溶液的焰色为黄色。根据以上实验现象,下列关于原溶液中离子成分的推测正确的是()
正确答案
解析
略
知识点
扫码查看完整答案与解析